がん組織モデル内部の細胞状態を"無標識・非破壊”で観察することに成功
がん組織モデル内部の細胞状態を "無標識・非破壊”で観察することに成功
国立大学法人東京農工大学大学院工学研究院先端物理工学部門の伊藤一陽助教、生物システム応用科学府食料エネルギーシステム科学専攻の飯嶋雄太氏(5年一貫制博士課程4年)、工学府産業技術専攻の三角朋生氏(博士前期課程2年)、工学研究院先端物理工学部門の生嶋健司教授、吉野大輔准教授、国立研究開発法人物質・材料研究機構(NIMS)の早瀬元主任研究員、国立大学法人浜松医科大学光医学総合研究所の田村和輝助教の共同研究グループは、がん組織モデル(がんスフェロイド)の成熟に伴う内部の細胞状態を、超音波イメージング技術を用いて三次元構造を保ったまま無標識かつ非破壊で可視化することに成功しました。本成果を応用することで、がんの原発病巣から転移する過程や、組織内部の動態を生体に近い環境で観察できるようになることが期待され、がん研究や再生医療の大幅な進展に貢献すると考えられます。
本研究成果は、npj Biomedical Innovations(6月13日付)に掲載されました。
論文名:Biochemical state in tissue can be detected through ultrasound signal
URL:
https://www.nature.com/articles/s44385-025-00026-w
本論文に関連する先行研究
論文名:Biological characterization of breast cancer spheroid formed by fast fabrication method
掲載誌:In vitro models, Volume 3, pages 19–32, 2024.
URL:https://doi.org/10.1007/s44164-024-00066-3
プレスリリース「簡単に作製可能ながん組織モデルでがん研究に新たな展開」
URL:https://www.tuat.ac.jp/outline/disclosure/pressrelease/2023/20240214_01.html
背景
スフェロイドとは、細胞が凝集して球状にまとまった細胞集合体のことで、従来の細胞培養ディシュ上の二次元培養ではなく、三次元的に培養をすることが特徴です。三次元培養することで、私たちの体内に近い環境を再現するがん組織モデル(がんスフェロイド; 注1)は、がん研究や創薬の現場で重要性が高まっています。しかし、がんスフェロイド内部の細胞状態の変化を、壊さず・染めず(標識せず)に観察することは長年の課題でした。従来の光学顕微鏡では、観察できる深さに限界があるため、厚みのあるがんスフェロイドの内部を詳細に捉えることが困難であり、これを克服する必要がありました。
研究体制
本研究は中谷医工計測技術振興財団技術開発研究助成(奨励研究)、JSPS 科研費(21K19893)、テルモ生命科学振興財団による支援のもと、東京農工大学、物質・材料研究機構(NIMS)、浜松医科大学で実施されました。
研究成果
本研究では、医療現場でエコー検査として広く使われる「超音波観察(注2)」を応用し、がんスフェロイド内部の構造をそのままのかたちで観察することに成功しました(図1)。これにより、内部の収縮や細胞の死といった重要な変化を、リアルタイムかつ非破壊的に“のぞき見る”ことが可能になりました。
まず、先行研究(Iijima et al.,
In vitro models
2024) において本研究グループが明らかにしたがんスフェロイド内部の動態変化―特に収縮、プログラム細胞死(アポトーシス)、細胞の壊死(ネクローシス)―を踏まえ、それらが超音波信号にどのように反映されるかを明らかにしました。がんスフェロイド内部のエコー輝度(注3)や輝度密度の空間的な変化を解析し、細胞の増殖、アポトーシス、ネクローシスに伴う輝度パターンを特定しました(図2)。特に、培養3日目以降にがんスフェロイド中心部の輝度が急激に低下し、15日目にはほぼゼロとなる傾向が確認され、これは壊死コア(注4)の形成を示唆しています。
さらに、細胞骨格の一種であり、スフェロイドの収縮に関わるアクトミオシンの働きを薬剤で抑制すると、輝度パターンに有意な変化が現れ、細胞力学がスフェロイドの内部構造形成に重要な役割を果たしていることが示されました(図3)。
これらの成果は、超音波の「深部まで届く」「標識不要」「リアルタイム観察可能」という特長を活かして、がんスフェロイドだけでなく、スフェロイド全般やオルガノイド(注5)といった三次元培養系の新たな解析手法として有望であることを示しています。
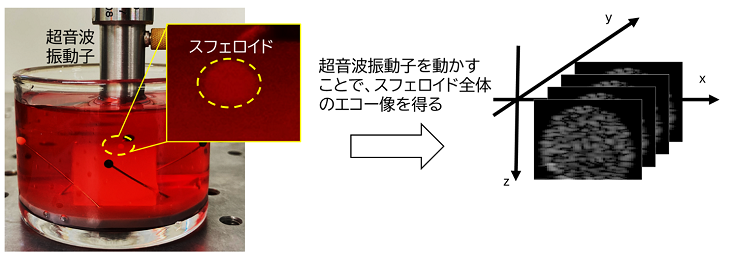
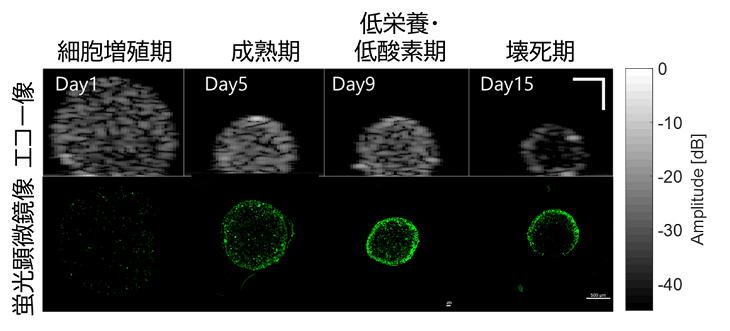
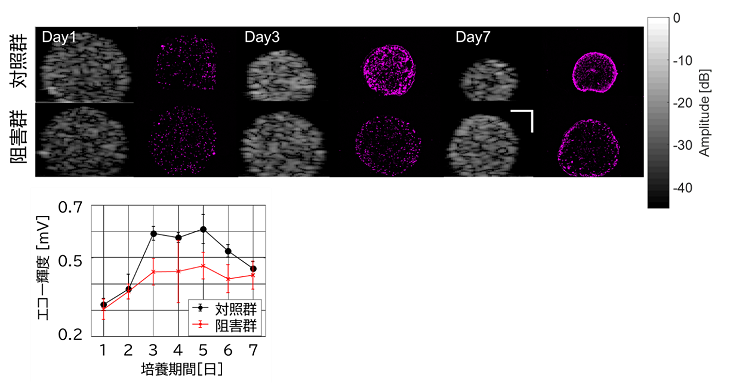
今後の展開
本研究により、超音波を用いてがんスフェロイド内部の動態変化を非破壊かつ無標識で可視化できることが実証されました。今後は、本手法の空間解像度を向上させて腫瘍の薬剤応答性評価や悪性度判定に応用し、より生体に近い共培養モデルやオルガノイドへの適用拡大を図ることで、がん研究や再生医療分野の発展に貢献することが期待されます。
用語解説
注1)がんスフェロイド
多くのがん細胞が集合、凝集して球状の塊となったもの。
注2)超音波観察
私たちの耳には聞こえないほど高い周波数の音(超音波)を使って、体の中や細胞の様子を観察する技術。医療現場では「エコー検査」として知られており、胎児の観察や内臓の診断などに広く用いられている。非破壊的であり、放射線を使わない安全な観察法であることが特徴。
注3)エコー輝度
超音波を使って得られた画像の中で、各部分がどれだけ明るく映るかを示す指標。この明るさは、細胞や組織の内部に当たった超音波が、超音波プローブに戻ってくる強さによって決まる。エコー輝度が高い部分は、超音波が強く戻ってきたことを意味し、細胞が密に集まっていたり、音響的な性質の異なる構造が存在していることを示唆する。
注4)壊死コア
スフェロイド内部で壊死した細胞が塊上になったもの。ネクロティックコアとも呼ばれる。
注5)オルガノイド
人工的に作製された、生体の臓器や組織を模倣した三次元細胞凝集体。
◆研究に関する問い合わせ◆
東京農工大学大学院工学研究院
先端物理工学部門 助教
伊藤 一陽(いとう かずよ)
TEL/FAX:042-388-7807
E-mail:itokazuyo(ここに@を入れてください)go.tuat.ac.jp
◆報道に関する問い合わせ◆
東京農工大学 総務課広報室
TEL:042-367-5930
E-mail:koho2(ここに@を入れてください)cc.tuat.ac.jp
浜松医科大学 総務課広報室 広報・基金係
TEL:053-435-2151
E-mail:koho(ここに@を入れてください)hama-med.ac.jp
関連リンク(別ウィンドウで開きます)
