〔2016年9月28日リリース〕悪性脳腫瘍や遺伝性貧血の発症メカニズムを解明
2016年9月28日
悪性脳腫瘍や遺伝性貧血の発症メカニズムを解明
ポイント
- 悪性脳腫瘍や遺伝性貧血にかかわるCHTOPタンパク質の細胞内濃度を調節しているメカニズムを明らかにした。
- CHTOPタンパク質の細胞内濃度は自身のmRNAの合成と分解のバランスを自己制御することで調節されていた。
- このメカニズム解明により、悪性脳腫瘍や遺伝性貧血の治療薬の開発が期待できる。
細胞は遺伝情報をもとに作られたRNAとタンパク質の相互作用を制御することでその働きを維持していますが、遺伝性の脳神経疾患などの難治性RNA代謝異常症の多くは、この相互作用の制御ができなくなることで起こると考えられています。そのためRNAとタンパク質の相互作用の実態とその制御のメカニズムを理解することは、RNA代謝異常症の発症メカニズムの解明から治療薬の開発につながると期待されています。
東京農工大学の泉川 桂一 助教と高橋 信弘 教授、首都大学東京の礒辺 俊明 特任教授らのグループは、RNA代謝異常症にかかわるCHTOPとRNAの結合で生じる複合体を最新の質量分析法で解析し、CHTOPが自分自身のメッセンジャーRNA(mRNA)の前駆体に結合し、自らのmRNAを分解に導くことで、細胞内濃度を自律的に調節していることを明らかにしました。
CHTOPは悪性脳腫瘍であるグリオブラストーマ注1)の形成や、サラセミア注2)や鎌形赤血球症注3)などの遺伝性貧血症の調節を行うタンパク質として知られていることから、この調節メカニズムの解明は、将来これらの疾患の治療薬の開発に繋がると期待されます。
本研究の成果は、日本時間の平成28年9月29日付でNucleic Acids Research誌(Oxford University Press社)のオンライン版に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」
(研究総括:田中 啓二 東京都医学総合研究所 理事長兼所長)
研究課題名:「RNA代謝異常症のリボヌクレオプロテオミクス解析と構造生命科学への展開」
研究代表者:礒辺俊明(首都大学東京大学院理工学研究科 特任教授)
研究期間:平成25年4月~平成31年3月
JSTは本領域で、先端的ライフサイエンス領域と構造生物学との融合により、ライスサイエンスの革新に繋がる「構造生命科学」と先端基盤技術の創出を目指します。上記研究課題では、RNAの質量分析技術とプロテオミクスを融合したRNAとタンパク質の相互作用解析法を高度化し、RNAの代謝異常に起因するヒトの難治性疾患の原因タンパク質とRNAが形成する複合体の解析に応用することで、その細胞内での役割や病理との繋がりを解析します。この研究は、RNAとタンパク質の相互作用が織りなす生命活動の解析に新たな手段を提供するとともに、RNA代謝異常症の原因の解明から治療薬の開発に繋がる構造生命科学研究に新しい展開をもたらすことを目指しています。
<研究の背景>
グリオブラストーマ(膠芽腫)は、腫瘍の中でも最も治療が難しい悪性の脳腫瘍です。この腫瘍の治療法としては外科手術が一般的ですが、手術によって腫瘍を全て摘出するのは困難なため、同時に放射線療法や化学療法が試みられます。しかし、その効果は弱く、グリオブラストーマ患者の1年生存率は50%、3年生存率は10%を少し超える程度と、非常に低いのが現状です。
このような状況の中で、最近グリオブラストーマが腫瘍を形成するメカニズムが明らかになってきました。この腫瘍の幹細胞の染色体DNAでは、DNAを構成する塩基の1つであるシトシンに5-ヒドロキシメチル化と呼ばれる化学修飾が高い頻度で起っており、その結果生じる5-ヒドロキシメチルシトシン(5hmC)注4)を目印としてCHTOP-メチロソーム複合体注5)が集合し、その周辺のDNAに結合したヒストンをメチル化することで腫瘍形成に関わる遺伝子を活性化、グリオブラストーマの形成を促進します。したがって、もとの幹細胞DNAの5hmC修飾を阻害するか、CHTOP-メチロソーム複合体の働きを阻害することで腫瘍形成を抑制できると考えられます。
<研究の内容と成果>
今回、東京農工大学の泉川 桂一 助教・高橋 信弘 教授、首都大学東京の礒辺 俊明 特任教授らのグループは、独自に開発を進めてきた日本発の最先端の質量分析法を利用してCHTOPとRNAの結合で生じる複合体を解析することで、CHTOP-メチロソーム複合体の働きを抑える方法を発見しました。すなわち、CHTOPは自分自身を合成する鋳型であるメッセンジャーRNA(mRNA)を形成する前段階のmRNA前駆体に結合することで、イントロンリテンション注6)とナンセンス変異依存mRNA分解機構(NMD)注7)で自分自身のmRNAを分解するという調節メカニズムで発現量を調節していることがわかりました(図1)。正常な細胞では、このメカニズムによって細胞内のCHTOPの量を一定に保っていますが、グリオブラストーマでは、これが破綻してCHTOPの量が異常に増えることで腫瘍形成が促進されていると考えられます。したがって、CHTOPの発現量を調節するメカニズムについての今回の発見は、将来、CHTOPの発現を阻害する薬の開発によってグリオブラストーマの治療法の開発が期待されています。
また、この発見は遺伝性の貧血症のうち、世界で最も患者数の多いタイプの治療薬の開発に結びつくと期待されています。現在、およそ4億?5億人の人達が血液中で酸素を運ぶ働きを持つヘモグロビンの遺伝子に変異を持つことが知られており、多くの人々がそれに起因する貧血症に悩んでいます。特にサラセミアや鎌形赤血球症と呼ばれる疾病は重篤で死に至ることもあります。この疾病の治療法としては骨髄移植や遺伝子治療が有効ですが、移植には適正なドナーが必要なだけでなく治療後も免疫抑制剤の投与が不可欠で、その後は感染症にかかる率が高くなる恐れがあり、また遺伝子治療には多くの課題があるのが現状です。
一方、ヘモグロビンは、胎児と成人では異なる遺伝子から作られます。成人の貧血症は成人で働く遺伝子から作られるヘモグロビンに異常があるために起りますが、同じ人の胎児期に働く遺伝子から作られるヘモグロビンは正常です。そこで、成人の貧血症の患者さんの異常ヘモグロビンを作る遺伝子の働きを成人では働いていない胎児期の遺伝子に変換して正常なヘモグロビンを作らせれば貧血症が治療できます(図2)。CHTOPは、ヒトの成長過程で発現量を増加させることで胎児期に働くヘモグロビン遺伝子を成人で働く遺伝子へと変換する働きがあることが知られています。したがって、今回発見した機構を利用してCHTOPの発現量を抑制する化合物を探索することで、将来この悪性の遺伝性貧血を治療できることが期待できます。
<今後の展開>
本研究から、悪性脳腫瘍形成のメカニズムの解明や遺伝性貧血の制御技術開発が進展し、将来的には予防・治療方法の確立につながることが期待されます。
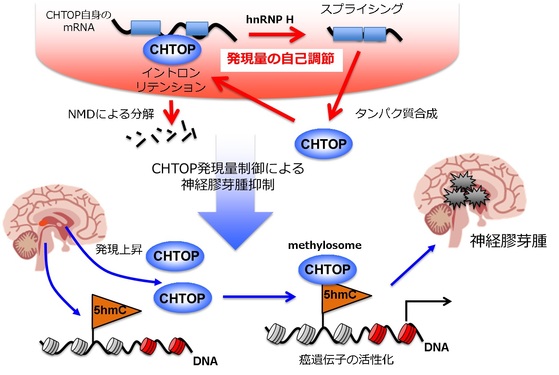
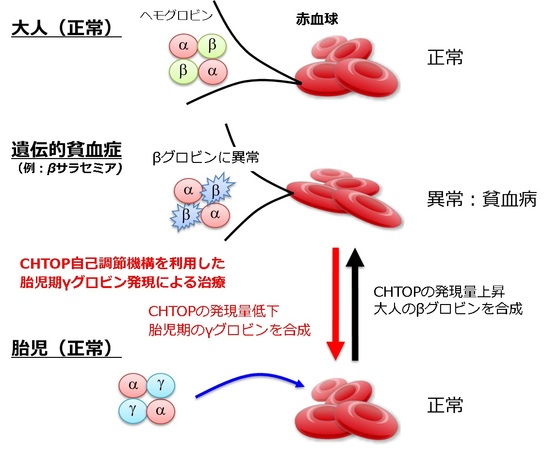
図2 世界で最も患者数が多い遺伝性貧血を制御する機構を解明
<用語解説>
注1) グリオブラストーマ(膠芽腫)
脳のグリア細胞が腫瘍化した悪性の腫瘍で、その中でも特に未分化状態で増殖性が高い細胞が腫瘍化したもの。転移・浸潤は脳の中に留まっており、治療困難である。
注2) サラセミア
ヘモグロビンを構成するグロビン遺伝子の異常による貧血。ヘモグロビンを構成しているα鎖あるいはβ鎖をコードする遺伝子の異常により、正常なタンパク質ができないため、酸素を運搬するヘモグロビンの本来の機能に欠陥が生じて貧血となる。地中海沿岸に多いので地中海貧血、地中海性貧血とも呼ばれる。
注3) 鎌形赤血球症
サラセミアと同様にヘモグロビンに異常を生じる遺伝性の貧血病で、赤血球の形状が鎌状になる特徴があるためにこの名前がある。ヘモグロビンの酸素運搬機能が低下して起こる貧血症で、主にアフリカ、地中海沿岸、中近東、インド北部などで患者数が多い。
注4) 5-ヒドロキシメチルシトシン
DNAを構成する塩基であるシトシンの修飾の1つで、ヒトやマウスの神経組織では高レベルでその存在が確認されている。幹細胞の自己複製、がんの発症や進行、神経疾患など多くの分野において、遺伝子発現のオン/オフに関与するなど潜在因子として、注目を集めている。
注5) CHTOP-メチロソーム複合体
CHTOPとタンパク質のメチル化酵素が結合して形成される複合体。遺伝子DNAに結合しているヒストンタンパク質をメチル化することで、特定の遺伝子を活性化して細胞増殖などを促進する働きがある。
注6) イントロンリテンション
スプライシングの際に全てのイントロンを除去せずに特定のイントロンを残したままにすること。
注7) ナンセンス変異依存性mRNA分解機構(NMD)
突然変異やイントロンテンションなどによって、本来の終止コドンの位置ではない位置に終止コドンが入ってしまった際に、これを異常と感知してmRNAを分解してしまう
<論文タイトル>
“Chtop (Chromatin target of Prmt1) auto-regulates its expression level via intron retention and nonsense-mediated decay of its own mRNA.”
(Chtop(Chromatin target of Prmt1)タンパク質の発現量は自身のmRNAのイントロンリテンションとナンセンス変異依存性mRNA分解機構によって自律的に調節されている)
doi:10.1093/nar/gkw831
<お問い合わせ先>
<研究に関すること>
高橋 信弘(タカハシ ノブヒロ)
東京農工大学 大学院農学研究院 教授
〒183-8509 東京都府中市幸町3-5-8
Tel:042-367-5709
E-mail:ntakahas(ここに@を入れてください)cc.tuat.ac.jp
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:crest(ここに@を入れてください)jst.go.jp
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:jstkoho(ここに@を入れてください)jst.go.jp
首都大学東京 URA室
〒192-0397 東京都八王子市南大沢一丁目1番地
Tel:042-677-2728 Fax:042-677-5640
E-mail:ragroup(ここに@を入れてください)jmj.tmu.ac.jp
