植物ウイルスの複製装置の形成の鍵となる膜結合領域を発見
植物ウイルスの複製装置の形成の鍵となる膜結合領域を発見
研究概要
国立大学法人東京農工大学大学院農学研究院生物制御科学部門の小松健准教授、有江力教授、同大学大学院農学研究院応用生命化学部門の佐々木信光准教授、同大学大学院農学府生物制御科学専攻の鈴木健央氏(2017年3月修士課程修了)、増島侑紀氏(2018年3月修士課程修了)およびオクラホマ州立大学のRichard Nelson博士を中心とする国際研究グループは、花卉類に大きな被害を及ぼす植物ウイルス(植物に感染するウイルス)が宿主の細胞内で効率的に増殖するための構造である「複製装置」の形成の鍵となる膜結合領域を発見しました。生化学的解析・バイオイメージング解析・および核磁気共鳴法により、本膜結合領域が、1)疎水性と親水性をあわせもつ両親媒性ヘリックスという構造をとり宿主の生体膜に強く結合すること、2)本ヘリックスの中央部がプロリンというアミノ酸により湾曲していること、3)本ヘリックスを構成するアミノ酸が変異するとウイルスが増殖できなくなること、4)本ヘリックスがウイルス複製装置の形成に関わること、を明らかにしました。本研究で発見された、湾曲した両親媒性ヘリックスという非常にユニークな構造をもつ膜結合領域は、複数の植物ウイルスの複製酵素で同様に見出されており、この領域をターゲットにした植物ウイルス防除剤の開発につながる可能性があります。
本研究成果は、2021年7月26日にJournal of Virology誌への掲載が決定し、9月27日にオンライン公開されました。
論文名:Identification of a proline-kinked amphipathic α-helix downstream from the methyltransferase domain of a potexvirus relicase and its role in virus replication and perinuclear complex formation
DOI: 10.1128/JVI.01906-20
URL: https://journals.asm.org/doi/10.1128/JVI.01906-20
研究背景
植物ウイルスは多くの農作物に感染し被害をもたらしており、特に近年、農業のグローバル化に伴い、ウメ輪紋ウイルスの日本での発生など、新たなウイルス病の発生の報告が増加しています。一方で、多くの動物ウイルスと同様、植物ウイルスの感染を抑える薬剤は開発されておらず、将来的な植物ウイルスの被害を抑えるためには、植物ウイルスの増殖機構、特に宿主細胞でその数を増やしていく「複製」のしくみの理解が非常に重要となります。
動植物に感染するウイルスの複製は宿主細胞の細胞内膜系(注1)を利用して行われます。これまでの動植物ウイルスの研究により、ウイルスが細胞に侵入するとまず、ウイルスのもつ膜局在性(注2)のタンパク質により細胞内膜系が改変され、膜構造におおわれた複製装置が形成されることがわかっています。この複製装置により、ウイルスは宿主細胞の攻撃を避け効率的に自身を複製できます。
このようにウイルスの複製装置の形成はその感染の成立に不可欠な過程です。このことから、全てのウイルスが自身のゲノムを複製させるために持つタンパク質である複製酵素(注3)は、ゲノムを複製させるポリメラーゼ(注4)活性に加えて、生体膜に結合する領域を有すると考えられます。しかし、ほとんどのウイルスで、複製酵素に存在する膜結合領域は同定されておらず、予測も困難でした。その理由の一つとして、多くの生物で膜結合に関与することが知られており、アミノ酸配列から予測が可能な「膜貫通領域」(注5)が、多くの場合ウイルスの複製酵素には見出されないことがあげられます。
研究成果
東京農工大学大学院農学研究院生物制御科学部門の小松健准教授らの研究チームは、世界中でさまざまな農作物に甚大な被害をもたらしている植物ウイルスの一群「ポテックスウイルス」の1種であるオオバコモザイクウイルス(Plantago asiatica mosaic virus: PlAMV)の複製酵素から、複製装置形成に必須な膜結合領域を見出しました。
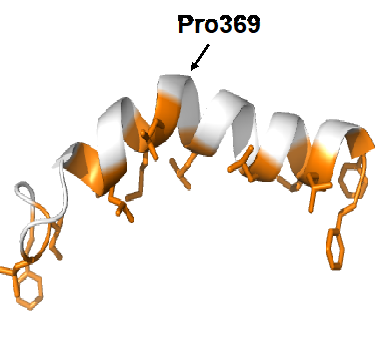
本研究では、まず、遠心分離法を用いた生化学的解析により、PlAMVの複製酵素(全長1380アミノ酸)のうち、植物の膜成分に結合する領域を74アミノ酸にまで絞り込みました。この領域には、いくつかのウイルスで膜結合に関与することが示されている両親媒性αヘリックス(注6)が予測されました。この推定αヘリックス領域の28アミノ酸をペプチド合成し核磁気共鳴法(注7)によりその立体構造を解析した結果、この膜結合領域は中央部のプロリン残基で36.7°湾曲したαヘリックス構造をとり、片側に疎水性のアミノ酸が、もう一方に親水性のアミノ酸が並ぶ両親媒性をもつことがわかりました(図1)。
次に、本ヘリックスを構成するアミノ酸のうち、異なるポテックスウイルス種でも性質的に保存されている疎水性アミノ酸およびプロリンに変異を導入したところ、いくつかの疎水性アミノ酸およびプロリンへの変異によって複製能が失われました(図2)。このことから、膜結合能を有する両親媒性αヘリックスがウイルスの複製に重要な役割を果たすことがわかりました。
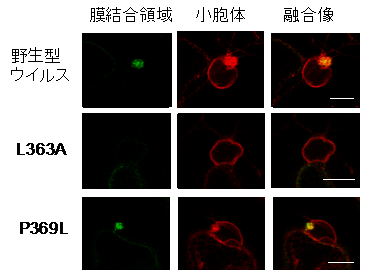
さらに、膜結合領域に緑色蛍光タンパク質(注8)を融合させ、バイオイメージング解析によりその細胞内局在を調べた結果、PlAMVの膜結合領域は細胞内の核周辺で小胞体に取り囲まれた凝集構造を形成していました(図3)。この構造はこれまでに植物ウイルスで報告されている複製複合体に特徴的なものです。そこで、両親媒性αヘリックスで保存されたアミノ酸の複製複合体形成に対する影響をアミノ酸への変異導入により調べたところ、複製に必要なアミノ酸は複製複合体形成にも重要であることが示されました。このことから、本ヘリックスがウイルス複製装置の形成に関わることが示されました。
本研究での、ポテックスウイルスの複製装置を形成する鍵となる膜結合領域の特定は、植物ウイルスの複製の仕組みに関するより詳細な解明に繋がるものです。今後、複製複合体に含まれ、複製を助ける役割を担う宿主のタンパク質の同定などにつながることが期待されます。
さらに、本研究で発見された湾曲した両親媒性ヘリックスは、RNAウイルスの膜結合領域としてユニークな構造である一方、複数の類縁ウイルスの複製酵素に同様に存在することが推測されました。今後解析が進むことで、本領域をターゲットにした植物ウイルス防除剤の開発につながる可能性があります。
研究体制
本研究は、国立大学法人東京農工大学大学院農学研究院生物制御科学部門の小松健准教授、有江力教授、同大学大学院農学研究院応用生命化学部門の佐々木信光准教授、同大学大学院農学府生物制御科学専攻の鈴木健央氏(2017年3月修士課程修了)、増島侑紀氏(2018年3月修士課程修了)、国立大学法人東京大学大学院農学生命科学研究科の難波成任特任教授、山次康幸教授、橋本将典助教、吉田哲也博士、学校法人法政大学生命科学部応用植物科学科の大島研郎教授、国立研究開発法人理化学研究所生命機能科学研究センターの渡部暁博士、栃尾尚哉博士、木川隆則博士、およびオクラホマ州立大学のRichard Nelson博士による国際研究グループによって実施されました。なお、本研究の一部は、日本学術振興会科学研究費補助金(19K06048)および東京農工大学グローバルイノベーション研究院の助成を受けて実施されました。
用語解説
注1)細胞内膜系
ミトコンドリアや葉緑体などの細胞内小器官や小胞体を含む、細胞内に存在する多様な膜組織。
注2)膜局在性
あるタンパク質などが、細胞内膜系や細胞膜などの脂質二重層で構成される膜成分に局在する性質を持つこと。
注3)複製酵素
全てのウイルスが保持する、自身のゲノム核酸を複製する機能を持つタンパク質。
注4)ポリメラーゼ活性
1本鎖の核酸を鋳型として、その相補的な核酸を合成する活性。ウイルスの保持するゲノムの種類により、RNAポリメラーゼとDNAポリメラーゼがある。
注5)膜貫通領域
多くの膜局在性のタンパク質がもつ、疎水性のアミノ酸が約20残基以上連なった脂質二重膜を貫通すると推測される領域。ソフトウェアにより容易にその存在を予測できる。
注6)両親媒性αヘリックス
アミノ酸がらせん状に連なったタンパク質の局部的な構造であるαヘリックスのうち、片側に疎水性、反対側に親水性のアミノ酸が並んだもののこと。この性質により、脂質二重膜に平行に埋め込まれるような膜局在性を示す場合が多い。
注7)核磁気共鳴法
強い磁場の中に試料を置き、試料分子の原子核間距離などの構造情報を取得できる手法。分子の立体構造解析に用いられる。
注8)緑色蛍光タンパク質
緑色の蛍光を発するオワンクラゲから発見されたタンパク質。調べたいタンパク質と融合させて細胞で発現させることで、タンパク質の細胞内局在のバイオイメージング解析に用いることができる。

◆研究に関する問い合わせ◆
東京農工大学大学院農学研究院
生物制御科学部門 准教授
小松 健(こまつ けん)
TEL:042-367-5692
E-mail:akomatsu(ここに@を入れてください)cc.tuat.ac.jp
関連リンク(別ウィンドウで開きます)
