ほ乳類が多くの匂いセンサーを有して様々な匂いを検知できる理由
ほ乳類が多くの匂いセンサーを有して
様々な匂いを検知できる理由
国立大学法人東京農工大学大学院工学府生命工学専攻の池上健太郎博士後期課程学生、大学院工学研究院生命機能科学部門の福谷洋介助教、養王田正文教授と米国デューク大学メディカルセンターの松波宏明教授らの研究グループは、マウス嗅覚受容体の細胞膜への自己輸送能とタンパク質の立体構造安定性が相関関係にあること、さらにヒト嗅覚受容体のアミノ酸使用頻度を基に創出した人工嗅覚受容体が他の嗅覚受容体に比べ非常に高い細胞膜局在を示すことを発見しました。哺乳類の嗅覚受容体は進化スピートが非常に早く、ヒトでは約400種の受容体が機能することで嗅覚の匂い応答を発揮しています。しかし、その多様性を獲得するための進化の過程でタンパク質立体構造の安定性が犠牲となり、他のタンパク質の補助を受けて機能を維持するようになったと考えられます。この成果により、今後、熱安定性の高い人工嗅覚受容体の創出技術開発や匂い分子応答メカニズムの詳細な解析が期待されます。
本研究成果は、米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America:PNAS)(2020年1月23日付)に掲載されました。
URL:https://www.pnas.org/content/early/2020/01/22/1915520117
現状
生物は嗅覚により環境中の匂いから、危険回避、食べ物の探索など様々な情報を得て生活を営んでいます。鼻腔内の上皮にある嗅覚神経細胞には嗅覚受容体(OR; Olfactory receptor)という膜タンパク質が発現しており、これが匂いセンサーとして働いています。嗅覚受容体は生物種ごとに数百~数千種類存在し、匂いに対する応答性がそれぞれ異なります。嗅覚受容体は細胞膜に局在することで機能を発揮するタンパク質ですが、多くの嗅覚受容体は単独では細胞膜に局在できず、Receptor transporting protein(RTP)というシャペロンタンパク質
(注1)
の補助を受けることで、細胞膜に局在します。これは嗅覚受容体タンパク質の低い熱安定性が原因として考えられ、実験で用いる培養細胞などでのタンパク質の大量生産が困難でした。そのため嗅覚受容体タンパク質レベルでの匂い分子結合などの生化学的な機能解析は分子構造モデルによるコンピューターシミュレーション等で行われており、実際の嗅覚受容体タンパク質を用いた生化学的な解析はされていませんでした。
研究体制
本研究は、東京農工大学大学院工学府生命工学専攻の池上健太郎 博士後期課程大学院生、大学院工学研究院生命機能科学部門の福谷洋介助教、養王田正文教授、米国Duke大学メディカルセンター Molecular genetics and Microbiology専攻 松波宏明教授(東京農工大学グローバルイノベーション研究院スーパー教授 兼任)らの国際共同研究グループによって実施されました。また本研究では、リーディング大学院プログラム、日本学術振興会頭脳循環を加速する戦略的国際研究ネットワーク推進プログラムの助成を受けて行われました。
研究成果
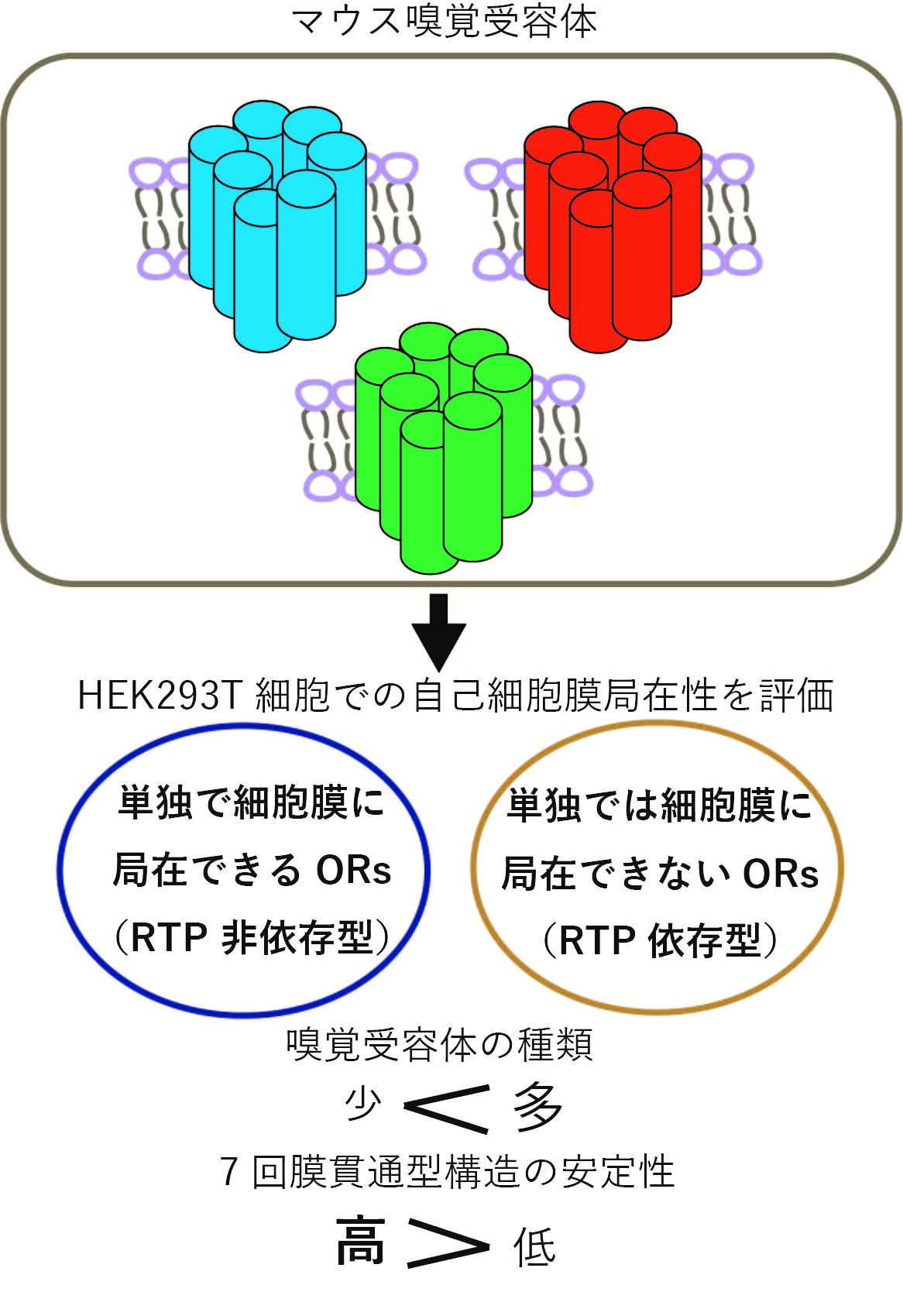
本研究グループでは、RTPノックアウトマウスを用いた実験で、大多数の嗅覚受容体が細胞膜に局在できず嗅覚応答が低下すること、しかし、一部の嗅覚受容体は細胞膜局在を保つため嗅覚を完全に失わないことを報告しています(Sharma et al., eLife 2017)。この報告を基に、本研究では、一定数の嗅覚受容体はRTPがなくても機能すると仮定し、約200種の嗅覚受容体の細胞膜局在性をヒト由来培養細胞HEK293T細胞を使い評価しました。すると、一部の嗅覚受容体は単独でHEK293T細胞に局在できることが分かりました(以下、本プレスリリースではTraffic ORsと記載します)。これらTraffic ORsの7回膜貫通タンパク質構造モデルを用いた分子シミュレーション解析により、単独で細胞膜に局在できる嗅覚受容体は他の嗅覚受容体に比べタンパク質の立体構造形成が安定していることが分かりました(図1)。Traffic ORsには保存性の高いアミノ酸が全体に散らばっていること、また、Traffic ORsはマウスの嗅覚受容体の系統樹に広く分布していたことから、ある特定の嗅覚受容体がTraffic ORsに属していないことが分かりました。
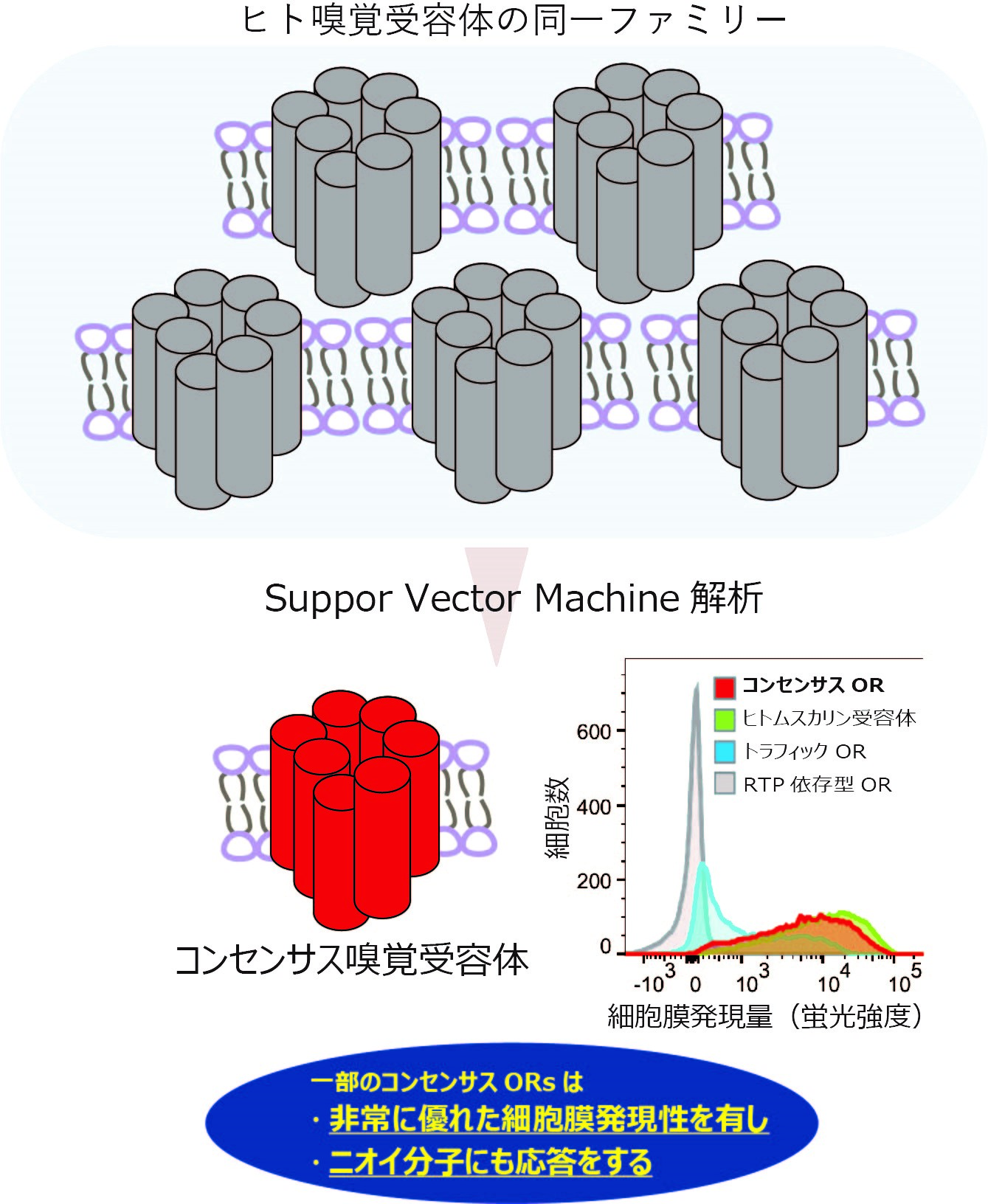
次に、ヒト嗅覚受容体のアミノ酸配列から分けられるグループ毎に、アミノ酸配列の共通性の高いコンセンサスORsを人工的に構築し、HEK293T細胞でその機能を評価しました。すると、一部のコンセンサスORsは非常に高い細胞膜局在を示し、かつ、匂い分子応答性を示しました(図2)。コンセンサスORsに対し、分子シミュレーション解析から熱安定性を高めると予測されたアミノ酸変異を導入したところ、さらに匂い分子応答性を保持したまま細胞膜局在量が増大したことから、嗅覚受容体のタンパク質の熱安定性と機能発現量の相関関係がここでも実証されました。
タンパク質の熱安定性と機能的発現量に相関を示すことはある程度予想できることですが、嗅覚受容体の場合1つのアミノ酸変異であっても、その機能性を大きく変化させます。嗅覚受容体はヒトでは約400種、マウスでは約1100種と非常に種類が多く、それは環境中の多彩な匂いに対応するために遺伝子変異の速度が速くなったと考えられています。アミノ酸に変異が起きることで、受容体が応答できる匂い分子が増える一方で、その代償としてタンパク質の構造安定性が低下してしまったと考えられます。しかし、生物はこの不安定な嗅覚受容体も機能させるために、Receptor transporting protein(RTP)といったシャペロンタンパク質を生み出し、多様な嗅覚受容体を機能させ、嗅覚を発達させるように進化を遂げていったと考えられます。
今後の展開
今回発見したTraffic ORsやコンセンサスORsは、単独で高いタンパク質発現を示すため、従来の嗅覚受容体では難しかった機能性のあるタンパク質を精製できるなど、嗅覚受容体タンパク質の機能解析を行いやすいと考えられます。また嗅覚受容体の細胞内での成熟化に至るプロセスはほとんど研究がされていません。多くの嗅覚受容体を補助するRTPに関しても、現在までにどのようにして嗅覚受容体を細胞膜に運ぶメカニズムは未解明で、本研究グループではRTPによる嗅覚受容体膜輸送機構の解明にも取り組んでいます(Fukutani et al., J Biol Chem 2019)。今後、RTPなどの補助を必要とする受容体とTraffic ORsの比較試験などを行うことで、嗅覚受容体の機能発揮に関する知見が広がる可能性が高いと考えられます。
また、Traffic ORsにはアミノ酸配列に共通性もみられたことから、今後より多くの嗅覚受容体の細胞膜局在性と匂い分子応答性の情報を網羅的に集め、その情報を集約することで、将来的にはある匂い分子に応答できる人工嗅覚受容体の創出なども可能になるかもしれません。
注1)
シャペロンタンパク質
タンパク質が機能を発揮するための立体構造の形成や適切な細胞内局在を助ける働きをするタンパク質の総称。
◆研究に関する問い合わせ◆
東京農工大学大学院工学研究院
生命機能科学部門 助教
福谷 洋介(ふくたに ようすけ)
TEL/FAX:042-388-7479
E-mail:fukutani(ここに@を入れてください)cc.tuat.ac.jp
関連リンク(別ウィンドウで開きます)
