東京農工大学発「新規脳梗塞治療薬」の臨床第Ⅱ相試験成功・目標達成
東京農工大学発「新規脳梗塞治療薬」の臨床第Ⅱ相試験成功・目標達成
国立大学法人東京農工大学大学院農学研究院応用生命化学部門の蓮見惠司教授らが発見した新規化合物群SMTPの一つTMS-007の新薬開発において、開発を手掛ける東京農工大発のバイオベンチャー(株)ティムス
*1
は、脳梗塞患者を対象とした臨床第Ⅱ相試験を完了し、安全性と有効性を確認しました。
2018年6月に、ティムスは米製薬大手Biogen
*2
との間に最大総額3億3500万ドル(現在の為替相場で約365億円)規模のオプション契約を締結しており、この結果を受けてBiogenはオプション権を行使し、TMS-007の承認に向けて本格的開発を加速することになります。
*1 東京都府中市宮町一丁目23番地の3 関口ビル5階(代表 若林拓朗)に本社を置く、臨床段階にある株式非公開のバイオテクノロジー企業。東京農工大学 蓮見惠司教授が率いる研究チームが発見した線溶系を制御する新しい発見に基づく治療法開発のために、2005年に設立された。
*2 アメリカ合衆国マサチューセッツ州ケンブリッジに本社を置き、「神経科学のパイオニア」を標榜する米国の製薬企業。1978年にCharles Weissmann、Heinz Schaller、Kenneth Murray、およびノーベル賞受賞者であるWalter GilbertとPhillip Sharpによって設立された、世界初のグローバルなバイオテクノロジー企業の一つ。
本研究成果は、米製薬大手バイオジェンと(株)ティムスの共同プレスリリース(2021年5月12日付)に掲載されました。
URL:http://media.biogen.com/news-releases/news-release-details/biogen-announces-exercise-option-acquire-investigational-drug(英文)
研究開発の経緯
SMTPは、蓮見惠司教授らがクロカビから発見した新規化合物群
*3
で、血栓溶解酵素プラスミンの前駆体プラスミノゲンの立体構造を変化させ、血栓への結合を促すとともにプラスミノゲンからプラスミンへの変換を促進することで血栓溶解作用を示します(文献1-3
*4
)。さらに、可溶性エポキシドヒドロラーゼ阻害作用に基づく抗炎症作用を併せ持っています(文献3,4
*4
,図:文献2から引用)。この活性により、種々の脳梗塞病態モデルで優れた効果を示します(文献2,3,5-17
*4
)。
TMS-007はSMTP同族体の一つで、(株)ティムスによって開発が進められています。上述のような作用機序の薬剤は従来になく、TMS-007は脳梗塞の治療に一大変革をもたらすと期待されます。
第Ⅱ相臨床試験に先立ち、ティムスは2015年8月に東京大学医学部附属病院 フェーズ1ユニットにおいて健常人を対象とした第Ⅰ相臨床試験を完了し、TMS-007の安全性を確認しています。また、第Ⅱ相臨床試験開始にあたり、「東京農工大学発『脳梗塞を治療する新薬候補』の臨床第Ⅱ相試験を開始」を公表しています〔2018年6月8日〕。
*3 クロカビStachybotrys microsporaが生産するtriprenyl phenolを基本骨格とする化合物群。頭文字をとってSMTPと命名。
*4 東京農工大学(発酵学研究室 鈴木絵里子講師と多くの学生、生物有機化学研究室 北野克和教授、他)、昭和大学薬学部(本田一男 元教授、野部浩司教授、柴田佳太准教授、橋本光正講師、他)、東北大学大学院医学系研究科(冨永悌二教授、新妻邦泰教授、現 秋田大学医学部 清水宏明教授、他)、東京大学医学部附属病院フェーズ1ユニット(山崎力 元教授、森豊隆志教授、他)、岡山大学医歯薬学総合研究科(阿部康二教授、現 山形大学医学系研究科 太田康之教授、他)、およびティムスとの間の共同研究。国立研究開発法人科学技術振興機構(JST)【研究成果最適展開支援事業フィージビリティスタディ可能性発掘タイプ シーズ顕在化(平成21–22年度);「知財活用促進ハイウェイ」大学特許価値向上支援(平成23年度);研究成果最適展開支援事業フィージビリティスタディ探索タイプ(平成23年度);研究成果展開事業 本格研究開発ステージ 実用化挑戦タイプ(平成23–26年度)】、文部科学省【科学研究費 基盤研究(B)(平成18–19年度);橋渡し研究加速ネットワークプログラム(平成26年度);科学研究費 基盤研究(B)(平成29–31年度)】、および国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)【イノベーション推進事業産業技術実用化開発助成事業(平成21年度);中小・中堅企業への橋渡し研究開発促進事業(平成27–29年度)】の支援を受けている。
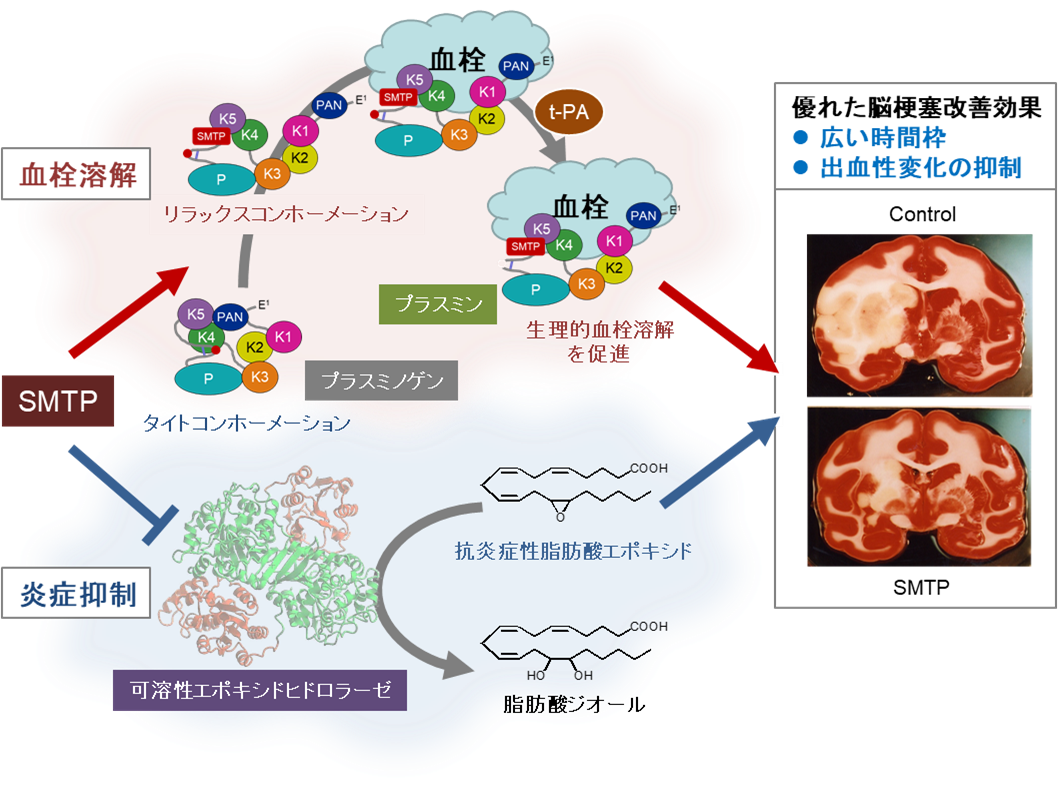
研究成果とそのインパクト
本研究は、多施設、単回投与、二重盲検、無作為化、プラセボ対照、用量漸増群間並行試験として、TMS-007の3群(1、3、6 mg/kg)とプラセボ群で行われました(TMS-007投与患者52例、プラセボ投与患者38例)。発症後12時間以内の急性虚血性脳卒中(脳梗塞)患者で、組織プラスミノゲン活性化因子(tPA)や血栓除去術が適用できない患者を対象として安全性と有効性を評価しました
*5
。
主要評価項目は、米国国立衛生研究所脳卒中スコア(NIHSSスコア)が4点以上悪化した症候性頭蓋内出血の発生率における安全性評価であり、TMS-007群ではイベントは発生しませんでしたが、プラセボ群では3%の発生率でした。このことから、TMS-007は、従来の血栓溶解剤で指摘されていたような重篤な頭蓋内出血の副次作用をもたないことが示されました。
さらに、TMS-007は、副次評価項目である90日後の機能的自立度mRS(modified Rankin Scale)についても、プラセボ投与群の18%に対し、TMS-007投与群の40%が、mRSスコアが0または1となり、症状が残らない、または重大な障害がないこと(有効性)を示しました(P <0.05)。この結果は、TMS-007を投与された大血管閉塞症患者の一部において、再開通を示す血管造影の証拠によって裏付けられました。磁気共鳴血管造影法MRAによる再開通率は、プラセボ投与群の26.7%(4/15)に対し、TMS-007投与群では58.3%(14/24)でした(オッズ比4.23、95%信頼区間(0.99, 18.07))。これまで数多くの脳梗塞治療薬候補物質が開発されてきましたが、そのほとんど全てが承認されず失敗に終わっています(脳梗塞に対する最後の血栓溶解剤が承認されてから約25年が経過)。TMS-007は、血栓溶解療法を受けられる可能性のある患者数を増やし、脳卒中後の機能的自立の可能性を高めることができると考えられます。
*5 日本医薬情報センター(JAPIC)登録番号JapicCTI-183842。治験調整医師: 冨永悌二 東北大学医学系研究科教授・東北大学病院長、医学専門家: 森豊隆志 東京大学医学部附属病院 教授・臨床研究推進センター長、独立データモニタリング委員会委員: 岩崎甫 山梨大学医学部特任教授・融合研究臨床応用推進センター長、木内博之 山梨大学医学部教授、隈部俊宏 北里大学医学部教授、治験統括責任者: 蓮見惠司 株式会社ティムス取締役。国内41施設で実施し、90症例を組入れ。
今後の展開
Biogenが、今後のTMS-007の開発、製造、商業化を実施します。同社は現在、TMS-007の臨床開発について、国際共同治験の計画を含め、次のステップを検討しています。今回の治験の最終的な結果は、今後、学会や学術誌で発表される予定です。
文献
- Hasumi K, Yamamichi S, Harada T (2010) Small-molecule modulators of the zymogen activation in the fibrinolytic and coagulation systems. FEBS J 277, 3675–3687.
- 蓮見惠司(2018)血栓溶解を促進する化合物―新たな脳梗塞治療薬の開発を目指して.化学と生物56,190–196.
- Hasumi K, Suzuki E (2021) Impact of SMTP targeting plasminogen and soluble epoxide hydrolase on thrombolysis, inflammation, and ischemic stroke. Int J Mol Sci 22, 954. https://doi.org/10.3390/ijms22020954.
- Matsumoto N, Suzuki E, Ishikawa M, Shirafuji T, Hasumi K (2014) Soluble epoxide hydrolase as an anti-inflammatory target of the thrombolytic stroke drug SMTP-7. J Biol Chem 289, 35826–35838.
- Hashimoto T, Shibata K, Nobe K, Hasumi K, Honda K (2010) A novel embolic model of cerebral infarction and evaluation of SMTP-7, a novel fungal triprenyl phenol metabolite. J Pharmacol Sci 114, 41–49.
- Shibata K, Hashimoto T, Nobe K, Hasumi K, Honda K (2010) A novel finding of a low-molecular-weight compound, SMTP-7, having thrombolytic and anti-inflammatory effects in cerebral infarction of mice. N-S Arch Pharmacol 382, 245–253.
- Miyazaki T, Kimura Y, Ohata H, Hashimoto T, Shibata K, Hasumi K, Honda K (2011) Distinct effects of tissue-type plasminogen activator and SMTP-7 on cerebrovascular inflammation following thrombolytic reperfusion. Stroke 42, 1097–1104.
- Shibata K, Hashimoto T, Nobe K, Hasumi K, Honda K (2011) Neuroprotective mechanisms of SMTP-7 in cerebral infarction model in mice. N-S Arch Pharmacol 384, 103–108.
- Akamatsu Y, Saito A, Fujimura M, Shimizu H, Mekawy MMM, Hasumi K, Tominaga T (2011) Stachybotrys microspora triprenyl phenol-7, a novel fibrinolytic agent, suppresses superoxide production, matrix metalloproteinase-9 expression, and thereby attenuates ischemia/reperfusion injury in rat brain. Neurosci Lett 503, 110–114.
- Sawada H, Nishimura N, Suzuki E, Zhuang J, Hasegawa K, Takamatsu H, Honda K, Hasumi K (2014) SMTP-7, a novel small-molecule thrombolytic for ischemic stroke: a study in rodents and primates. J Cereb Blood Flow Metab 34, 235–241.
- Hashimoto T, Shibata K, Ohata H, Hasumi K, Honda K (2014) Altered gene expression in an embolic stroke model after thrombolysis with tissue plasminogen activator and Stachybotrys microspora triprenyl phenol-7. J Pharmacol Sci 125, 99–106.
- Ito A, Niizuma K, Shimizu H, Fujimura M, Hasumi K, Tominaga T (2014) SMTP-7, a new thrombolytic agent, decreases hemorrhagic transformation after transient middle cerebral artery occlusion under warfarin anticoagulation in mice. Brain Res 1578, 38–48.
- Shibata K, Hashimoto T, Hasumi K, Honda K, Nobe K (2018) Evaluation of the effects of a new series of SMTPs in the acetic acid-induced embolic cerebral infarct mouse model. Eur J Pharmacol 818, 221–227.
- Huang Y, Ohta Y, Shang J, Morihara R, Nakano Y, Fukui Y, Liu X, Shi X, Feng T, Yamashita T, Sato K, Takemoto M, Hishikawa N, Suzuki E, Hasumi K, Abe K (2018) Antineuroinflammatory Effect of SMTP-7 in Ischemic Mice. J Stroke Cerebrovasc Dis 27, 3084–3094.
- Huang Y, Ohta Y, Shang J, Li X, Liu X, Shi X, Feng T, Yamashita T, Sato K, Takemoto M, Hishikawa N, Suzuki E, Hasumi K, Abe K (2018) Reduction of ischemia reperfusion-related brain hemorrhage by Stachybotrys microspora triprenyl phenol-7 in mice with antioxidant effects. J Stroke Cerebrovasc Dis 27, 3521–528.
- Shi X, Ohta Y, Shang J, Morihara R, Nakano Y, Fukui Y, Liu X, Feng T, Huang Y, Sato K, Takemoto M, Hishikawa N, Yamashita T, Suzuki E, Hasumi K, Abe K (2018) Neuroprotective effects of SMTP-44D in mice stroke model in relation to neurovascular unit and trophic coupling. J Neurosci Res 96, 1887–1899.
- Suzuki E, Nishimura N, Yoshikawa T, Kunikiyo Y, Hasegawa K, Hasumi K (2018) Efficacy of SMTP-7, a small-molecule anti-inflammatory thrombolytic, in embolic stroke in monkeys. Pharmacol Res Perspect 2018, e00448.
◆研究に関する問い合わせ先◆
東京農工大学大学院農学研究院 応用生命化学部門 教授
蓮見惠司(はすみ けいじ)
TEL:042-367-5710
FAX:042-367-5708
E-mail:hasumi(ここに@を入れてください)cc.tuat.ac.jp
