いのちを担う心臓が拍動し続けることができる理由の一端を心筋細胞を使って証明
いのちを担う心臓が拍動し続けることができる理由の一端を心筋細胞を使って証明
国立大学法人東京農工大学大学院工学府 材料健康科学寄附講座は、ストレスタンパク質・αB-クリスタリン(αB)が、心筋細胞の中で力のかかる横紋構造に局在していること、細胞骨格の1つである微小管から脱会合したチューブリンを素早く認識していることを明らかにしました。心筋細胞が1秒間に1回程度、自律して拍動することができるのは、αBが細胞骨格の短縮・伸長に伴う変化を動的に維持しているためだと考えられました。このミクロな発見は、人間が生きていることの基本原理につながり、今後は自発的に行う運動によりαBが骨格筋で誘導される条件を明らかにし、細胞・身体を連携して長く健康を保つ方法への展開が期待されます。
本研究成果はThe Journal of Biochemistry(2020年7月29日付)に掲載され、表紙を飾りました。
論文タイトル:Dynamic localization of αB-crystallin at the microtubule cytoskeleton network in beating heart cells
URL:https://academic.oup.com/jb/article/168/2/125/5877511
現状
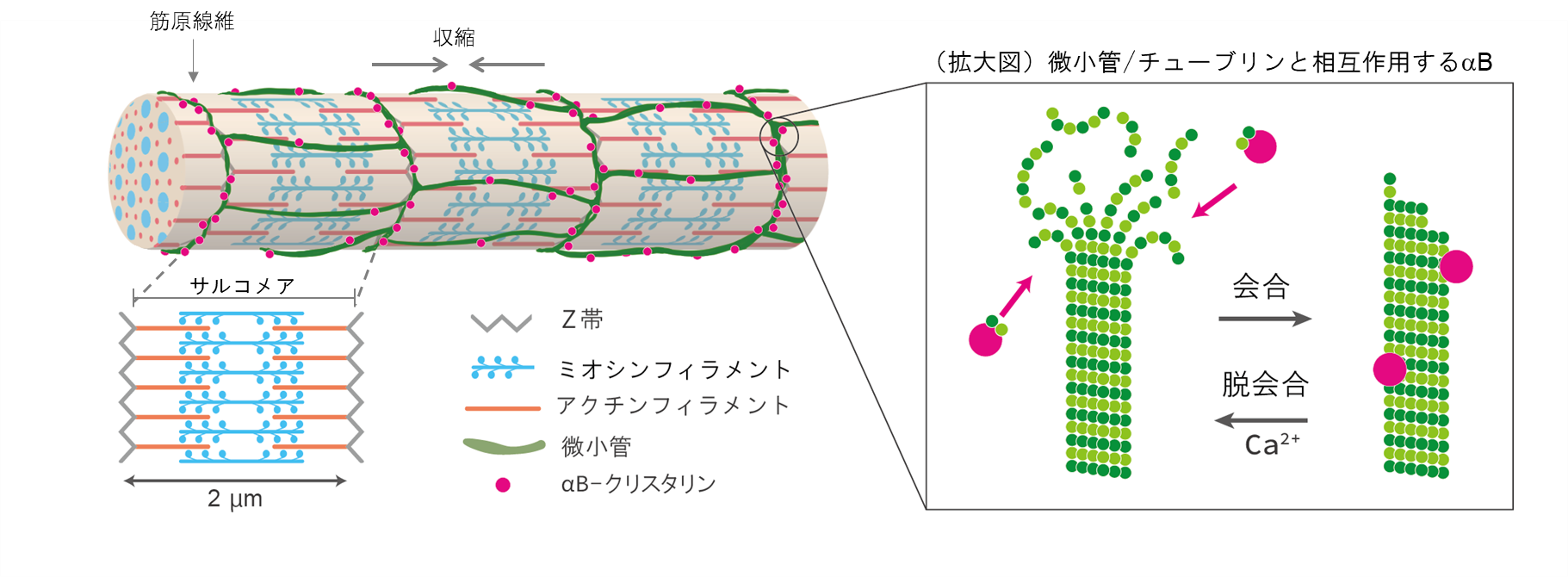
αBは、わたしたちが生きている限り1秒間に1回拍動し続ける心筋や、直立二足歩行を常態とするヒトで顕著に発達しているヒラメ筋など、恒常的に機械的・抗重力的ストレスがかかっている細胞に多く発現する低分子量ストレスタンパク質です。ストレスが多い細胞では、常にタンパク質の変性がおきているため、ホメオスタシス維持にはαBのようなお世話係のタンパク質が必要になります。αBは運動適応のマーカーを探索するなかで、寝たきりの動物モデル・後肢懸垂ラットでヒラメ筋の萎縮と同時に減る分子として同定され、筋の横紋構造のうち力のかかるZ帯に存在することを明らかにしました(図1)(Atomi et al., 1991)。これまでの細胞レベルの研究から、αBの多寡が細胞形態と接着を制御し(Shimizu et al., 2016)、繰り返し伸展ストレスへの耐性(Hayasaki et al., 2019)、生体を模倣した不安定で柔らかい基盤上での牽引力(Hayasaki et al., 2020)に影響を与えることを報告してきました。また、αBは細胞骨格タンパク質、とくにチューブリンと相互作用し、チューブリンの変性を防いでいることを、精製タンパク質の分光学的な濁度アッセイ(Arai and Atomi, 1997, Ohto-Fujita et al.,2007)や、グリオーマ・筋芽細胞を用いて示し(Fujita et al., 2004)、αBが細胞骨格タンパク質である微小管・チューブリンのお世話をしていることを明らかにしてきました。
研究成果
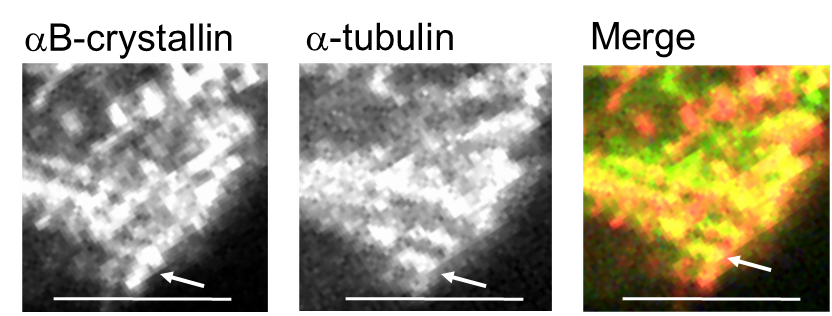
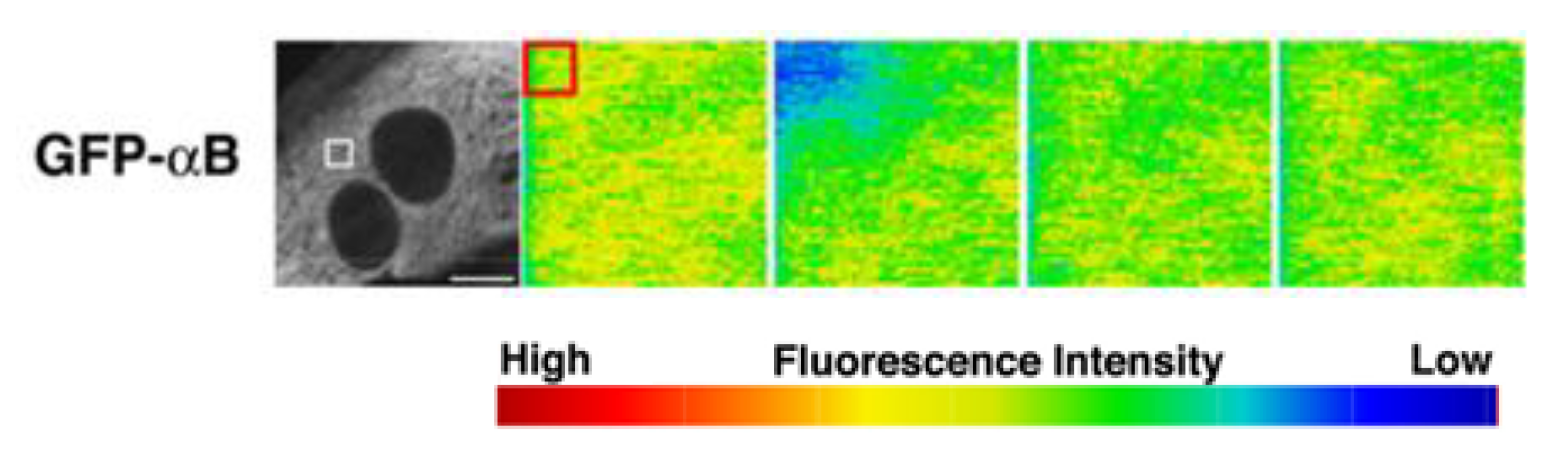
本研究では、自律的に拍動しているラット初代培養心筋細胞を用いて、αBとチューブリンのストレス下における直接的な相互作用をなるべく生体に近い条件でリアルタイムに観察しました。最初に、成体ラットの心筋の免疫組織化学によって、αBがチューブリンと共局在するかどうかを調べました。すると図2のように、横紋構造に局在することが分かりました。心筋は1秒に1回繰り返し拍動し続けるため、αBの働きも極めてダイナミックなはずです。そのような仮説をたてて、生きた心筋細胞の中でのαBの挙動をGFP(緑色蛍光タンパク質)のタグを付けて追跡しました。分子のダイナミクスを評価するFRAP(光褪色後蛍光回復法)を用いて、横紋構造のGFP-αBに強いレーザー光を照射したところ、驚くべきことに蛍光強度が1秒以内に戻りました(図3)。すぐに別のGFP-αBがその場所に移動してくることで、収縮のたびに変形させられる横紋構造タンパク質の変性に対して保護的に働いていることが示されました。このαBの挙動は、ノコダゾール処理でチューブリンと同調し、タキソール処理に同調しなくなることから、微小管ダイナミクスが必要であることも判明しました。この結果は、ヒラメ筋の廃用性萎縮時にαBが減少するという先行研究とよく一致しています。すなわちαBは、お世話する相手のタンパク質ダイナミクスがなくなると、仕事を失い、長期的には発現しなくなってしまうということです。これは細胞内のタンパク質ホメオスタシス維持にとっては危機的状況です。
筋細胞において、微小管ダイナミクスを止めてしまう要因として、微小管をばらけさせる、カルシウム濃度の一過性上昇が考えられました。そこで豚脳より単離精製した微小管を使い、in vitroでカルシウムを加えると、微小管からチューブリンが脱会合し、αBと共沈してくることを実証しました。αBとチューブリンの直接的な相互作用については、微小管阻害剤であるコルヒチン処理心筋細胞でFRET(蛍光共鳴エネルギー移動)により確認されました。
今後の展開
本研究により私たちのいのちを担う自律的に拍動してくれる心筋のメカニズムの一端を、αBと細胞骨格微小管のダイナミックな関係から明らかにしました。同じメカニズムは、αBがもっとも多く発現するヒラメ筋でも働いているはずです。αBは、仕事を与えられないと減少してしまいます。つまり、ヒラメ筋は伸展させなければ萎縮しαBが減ってしまいます。心筋は自律的に拍動しαBに仕事を与えてくれています。しかし、身体運動は「わたし」が「やろう!」と決意して実行しないと細胞に良い刺激が入りません。コロナ渦の運動不足は、αBとチューブリンとの関係で、私たちの健康問題にも大きく関わっています。αBは普段はオリゴマーを形成しますが、その構造が極めてフレキシブルなため、いまだ結晶構造が解かれていません。今後は、カルシウムストレス時のαBとチューブリンの相互作用のライブセルイメージングや共結晶構造解析などに取り組んでいきたいと考えています。

◆研究に関する問い合わせ◆
東京農工大学工学府応用化学専攻・材料健康科学寄附講座
客員教授 跡見 順子(あとみ よりこ)
TEL/FAX:042-388-7539
E-mail:yatomi(ここに@を入れてください)cc.tuat.ac.jp
関連リンク(別ウィンドウで開きます)
- 東京農工大学大学院工学府 材料健康科学寄附講座 研究室WEBサイト
