植物ウイルス抵抗性遺伝子のイントロンの協同的機能を解明
植物ウイルス抵抗性遺伝子のイントロンの協同的機能を解明
本研究のポイント
- タバコのウイルス抵抗性遺伝子Nに含まれる4つのイントロンの機能を調べました。
- プロモーターに近い2つのイントロンが協同的な機能をもち、遺伝子発現とウイルス抵抗性の調節に関与している可能性が示されました。
- イントロンの機能を活用した遺伝子改変技術に繋がることが期待されます。
研究概要
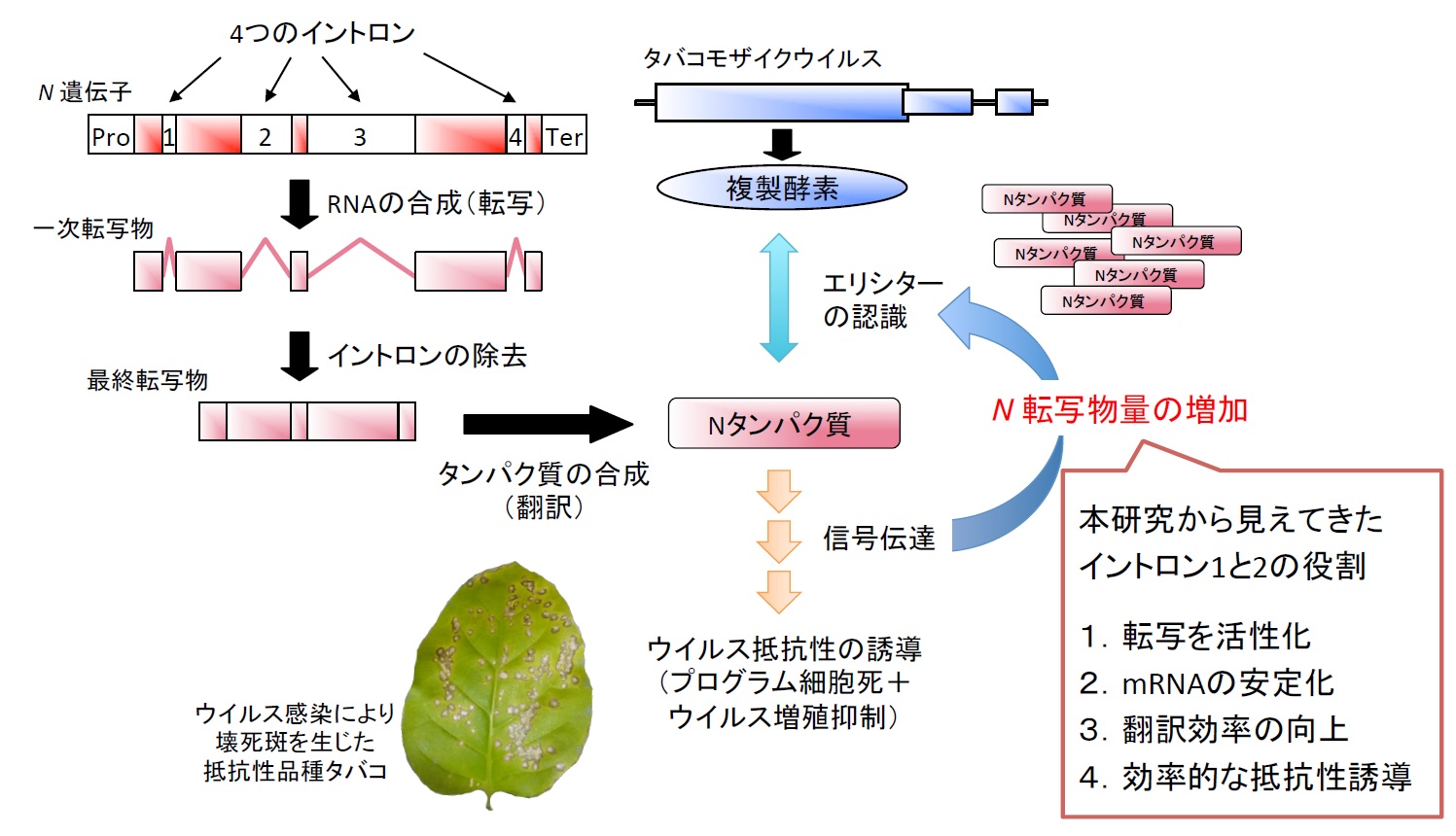
国立大学法人東京農工大学大学院農学研究院応用生命化学部門の佐々木信光准教授を代表とする国際研究グループは、タバコのウイルス抵抗性遺伝子Nがもつ4つのイントロンのうち、プロモーターに近いイントロン1とイントロン2が協同的に自身の転写物量の増大およびウイルス抵抗性の増強に寄与していることを明らかにしました。
研究チームは、N遺伝子をもたないタバコ品種で一過的に外来遺伝子を発現させる実験系を利用し、異なるイントロンの組み合わせをもつN配列がどのような機能をもつのかについて調査しました。その結果、イントロンを全く含まないN配列と比較して、イントロン1とイントロン2を両方含んでいるN配列では1)転写物量が大幅に増加すること、2)ウイルス因子を認識することで誘導される細胞死が強まること、3)ウイルスの感染抑制効果が高まることが判明しました。一方で、イントロン1あるいはイントロン2のみを含む場合には上述した効果が弱まることが示されました。また、転写物量だけで表現型が説明できない結果も一部で得られたことから2つのイントロンが転写物量だけでなくタンパク質量の調節にも関与していることが示唆されました。これらの結果は、タバコには複数のイントロンによる協同的な遺伝子発現調節機構が存在していることを示しており、今後N遺伝子を含む種々の遺伝子のイントロンの機能を明らかにしていくことにより、イントロンの機能に着目して標的遺伝子の構造を改変し、その遺伝子発現を効果的かつ精密に調節できるようになることが期待されます。
本研究成果は、2021年7月15日にScientific Reports誌への掲載が決定し、7月29日にオンライン公開されました。
論文名:Cooperative roles of introns 1 and 2 of tobacco resistance gene N in enhanced N transcript expression and antiviral defense responses
DOI: 10.1038/s41598-021-94713-4
URL: https://doi.org/10.1038/s41598-021-94713-4
研究背景
タバコ(Nicotiana tabacum)のN遺伝子は植物ウイルスに対する抵抗性遺伝子です。N遺伝子をもたないタバコ品種にタバコモザイクウイルス(TMV)が感染するとモザイク病が起こるのに対し、N遺伝子をもつタバコ品種にTMVが感染すると細胞死をともなう抵抗反応が誘導されるためウイルス感染は部分的に封じ込められます。N遺伝子とTMVはウイルス抵抗性の分子機構を解明するモデル実験材料として多くの研究で利用されています。これまでの研究からN遺伝子産物がウイルス複製酵素をエリシター(抵抗性誘導因子)として認識することで抵抗性が誘導されることが明らかとなっています。
N遺伝子は、TMV感染後に転写物量が急激に上昇すること、また、TMVを感染させなくてもアグロインフィルトレーション法(
注1
)を用いてTMVエリシターのみを一過的に過剰発現させると転写物量が増えることが分かっています。これは、ウイルス感染を認識してから効率的かつ効果的に抵抗性を誘導するという巧妙な遺伝子発現調節機構が存在しているためだと考えられています(図1)。しかし、このようなN遺伝子の発現調節がどのように行われているのかについてはほとんど分かっていませんでした。
本研究チームは、N遺伝子をもたないタバコ品種を用いて、N遺伝子自身のプロモーター制御下でN遺伝子を一過的に発現させる独自のモデル実験系を構築しました。この実験系において、導入したN遺伝子の転写物量がTMVエリシターの共発現下では著しく増大することを確認しました。さらに研究を進めたところ、N遺伝子に含まれる4つのイントロン(
注2
)をすべて取り除くと、TMVエリシターを共発現させた場合でも転写物量の著しい増大がみられず、それに関連して細胞死や抵抗性関連遺伝子の誘導が減弱することが示されました。
以上の結果から、N遺伝子の発現調節や抵抗性誘導にイントロンが重要な役割を果たしていることが明らかとなりましたが、4つのイントロンの内、どのイントロンがどのように関与しているのかは不明のままでした。
研究成果
本研究では、まずN遺伝子自身のプロモーターをCaMV 35Sプロモーター(
注3
)に置換し、4つのイントロンの有無がN遺伝子の転写物量にどのような影響を与えるのかについて経時的に調べました。その結果、N遺伝子がイントロンをもたない場合には転写物量がほぼ横ばいで推移するのに対して、イントロンがあると転写物量が大幅に増加していくことが分かりました。また、このイントロンの効果はN遺伝子産物とエリシターとの相互作用に依存しないことが示されました。
次にイントロンの組み合わせを改変したN遺伝子シリーズを用いて転写物量を比較する実験を行った結果、全イントロンをもつN遺伝子と同程度の転写物量を蓄積するためにはイントロン1とイントロン2の両方が必要かつ十分であることが分かりました。また、2つのイントロンのいずれかを単独でもつN遺伝子を解析したところ、イントロン1の場合は転写物量がある程度増えるもののイントロン2の場合では全く転写物量が増えませんでした。さらに、イントロン1には一次転写物(mRNA前駆体)の蓄積量を増加させる機能があることが示されたため、イントロン1を介して転写が活性化している可能性が考えられました。一方でイントロン2がイントロン1と協同して転写物を安定化させている可能性も示唆されましたが、転写物量を増加させる分子メカニズムの全容の解明は今後の課題です。
以上の結果を踏まえ、N遺伝子によるウイルス抵抗性誘導におけるイントロン1とイントロン2の役割を調べることにしました。ウイルス抵抗性の評価は、(1)タバコにおけるTMVエリシターに応答した細胞死誘導および(2)ベンサミアナタバコ(Nicotiana benthamiana
注4
)におけるトマトモザイクウイルス(ToMV)の感染抑制作用を比較することにより行いました。その結果、N遺伝子内にイントロン1とイントロン2の両方があれば全イントロンをもつ場合と同様の細胞死誘導と感染抑制作用を示すことが分かりました。また、イントロン1またはイントロン2のみをもつN遺伝子は、転写物量に有意な違いが認められるにもかかわらず、同程度の細胞死誘導と感染抑制作用を示しました。これらの結果は、イントロン1とイントロン2が転写物量だけでなくタンパク質量も調節している可能性を示唆しており、2つのイントロンの協同的な働きによって遺伝子発現およびウイルス抵抗性誘導が巧妙に調節されていると考えられます。
真核生物の遺伝子内にみられるイントロンの役割や機能はほとんど理解されていません。本研究で得られた結果はタバコにおいて遺伝子内の複数のイントロンが協同的に機能し、転写の活性化、転写物の安定化、翻訳の効率化に寄与していることを示唆しています(図1)。今後N遺伝子を含めた様々な植物のイントロンの機能を明らかにしていくことで、イントロンの機能に着目して標的遺伝子の構造を改変し、その遺伝子発現を効果的かつ精密に調節できるようになることが期待されます。
研究体制
本研究は、国立大学法人東京農工大学大学院農学研究院応用生命化学部門の佐々木信光准教授、松下保彦准教授、同大学大学院農学府応用生命化学専攻の池田千紘氏(2018年3月修士課程修了)、宮崎紡希氏(2019年3月修士課程修了)、白井梨花子氏(2020年3月修士課程修了)、同大学連合農学研究科応用生命科学専攻の多久和夫博士(2018年3月博士課程修了)、早稲田大学の丹生谷博博士およびオクラホマ州立大学(アメリカ)のRichard Nelson博士を中心とする国際研究グループによって実施されました。また、本研究の一部は、日本学術振興会科学研究費補助金基盤研究C(17K19260, 26450052, 19K06047)およびグローバルイノベーション研究院の助成を受けて実施されました。
用語解説
注1)アグロインフィルトレーション法
土壌細菌アグロバクテリウム(Rhizobium radiobacter、syn. Agrobacterium tumefaciens)を利用して、外来遺伝子を植物細胞のゲノムに導入し一過的に発現させる方法。
注2)イントロン(介在配列)
真核生物では転写直後の一次転写産物(mRNA前駆体)から切り出される塩基配列であり、アミノ酸配列に翻訳される情報を含まない。
注3)CaMV 35Sプロモーター
カリフラワーモザイクウイルス(Cauliflower mosaic virus、CaMV)に由来する転写プロモーター。植物細胞において外来遺伝子を恒常的に高発現させることができるため植物組換え実験でよく用いられる。
注4)Nicotiana benthamiana
タバコ近縁種であり植物ウイルスに対する感受性が高いことから様々な植物ウイルスの研究でよく用いられる。N遺伝子を一過的に発現させたN. benthamianaの葉では細胞死を起こさずにToMV(TMVの近縁種)の感染を抑制する。緑色蛍光タンパク質(GFP)をコードするToMV変異体を用いるとGFPの蛍光を指標としてウイルス増殖抑制効果を定量的に測定することができる。

◆研究に関する問い合わせ◆
東京農工大学大学院農学研究院
応用生命化学部門 准教授
佐々木 信光(ささき のぶみつ)
TEL:042-367-5840
E-mail:chaki(ここに@を入れてください)cc.tuat.ac.jp
関連リンク(別ウィンドウで開きます)
- 東京農工大学 佐々木信光准教授 研究者プロフィール
- 東京農工大学 佐々木信光准教授 研究室WEBサイト(遺伝子実験施設)
- 佐々木信光准教授が所属する 東京農工大学農学部応用生物科学科
