人間が立つことを支えるストレスタンパク質・αB-クリスタリンが、一細胞レベルでもふんばりを支え、かたちを制御していることを発見
人間が立つことを支えるストレスタンパク質・αB-クリスタリンが、
一細胞レベルでもふんばりを支え、かたちを制御していることを発見
東京農工大学大学院工学研究院応用化学専攻有機材料科学・材料健康科学寄付講座 跡見順子客員教授、清水美穂客員准教授をはじめとする研究チームは、ストレスタンパク質・αB-クリスタリン(αB)の多寡が、かたちの保持や接着といった細胞の基本的な機能を制御していることを、遺伝子工学的な手法を用いて世界で初めてあきらかにしました。αBは、不安定な二足立位姿勢を選んだ動物としての人間の筋活動を支えるタンパク質を追求するなかで我々が見出したタンパク質で、ヒラメ筋や脊柱起立筋といった抗重力筋で多く発現し、宇宙の微小重力環境実験動物モデルで顕著に減少します。細胞が重力に対抗してかたちを保持するためには、細胞外マトリクスとの接着に加えて、細胞骨格タンパク質との接着点における安定性が必要で、αBがその機能を担っていることが本研究から明らかになりました。この研究成果は寝たきりなど超高齢社会において重要となる疾病を予防するためのメカニズム解明につながることが期待されます。
本研究成果は、Plos One誌に2016年12月15日(米国東部時間)に掲載されました。
http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0168136
<研究の背景>
タンパク質はそのかたち(立体構造)が機能を決めています。熱ショックタンパク質(HSP)は、ストレスタンパク質、分子シャペロンとも呼ばれ、タンパク質のフォールディング(「かたち」生成)・リフォールディング(巻き戻し)をお手伝いします。生物は常に新しいタンパク質に作り替えられているので、HSPが必須です。タンパク質はその立体構造が機能を決めますが、作られるとき、実際に働くとき、ストレス時に、きわめてダイナミックに揺らいでいます。HSPの中での分子量の小さい仲間である「sHSPs」は、細胞をかたちづくる線維構造「細胞骨格タンパク質」や細胞が基盤に結合する支点をつくる複合体タンパク質の形のお世話をしています(図1)。中でも細胞骨格のアクチンとチューブリンは、球状タンパク質が会合して線維構造をつくりますが、球状と線維型の間でダイナミックに動態が制御されています。細胞がかたちを変える、刺激に応答するとき、ダイナミックな化学反応が起きていてタンパク質の形の変性を伴うため、HSPを必要とします。とくに「ふんばり続ける」活動は、生体分子にダメージを与える活性酸素を生み出すミトコンドリアの持久的な活動に依存しています。このように、メカニカルなストレスは、熱などのストレスと違って常時存在しています。αB-クリスタリン(αB)は、宇宙での微小重力環境を模倣した後肢懸垂ラットの萎縮したヒラメ筋(遅筋)において特異的に激減するタンパク質として跡見が同定したsHSPsのひとつで (Atomi et al., 1991)、細胞の正常機能に必須ですが、ユビキタスに発現しているため、その働きを明解に示すことは科学的に困難でした。また、αBはアルツハイマー病、パーキンソン病でみられる凝集タンパク形成の予防効果により医学的に注目されているタンパク質ですが、その生理機能は未解明でした。
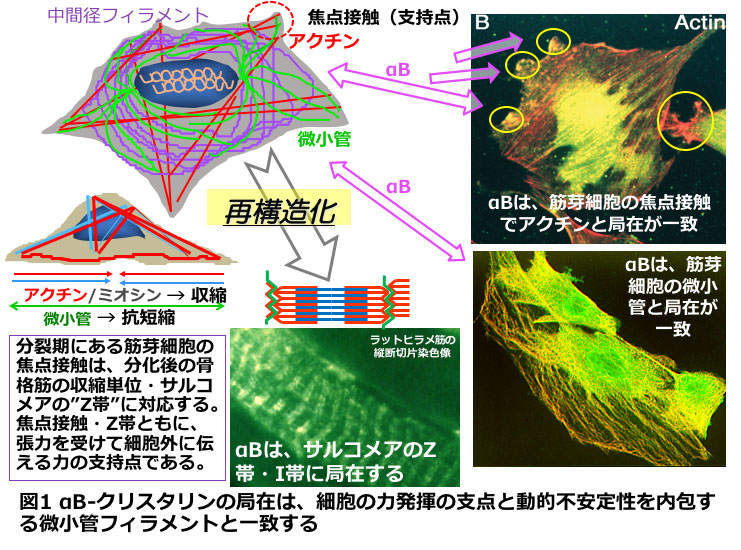
<研究体制>
本研究は、跡見順子(東京農工大学客員教授、東京大学名誉教授)と田中幹人(現早稲田大学社会学科大学院准教授)が東京大学大学院総合文化研究科在籍中に開始し、清水美穂(東京農工大学客員准教授)が加わって実施、3人の論文作成寄与は同等です。宇宙環境利用に関する公募地上研究、科学研究費補助金、宇宙基地利用基礎実験費の支援を受けました。
<研究成果>
分裂周期にある細胞では3つの細胞骨格が基本的には独立に制御されています。これらの細胞のαB発現を、脳のグリア細胞および筋芽細胞で増加させると細胞は広がった形態をとり、減少させると線維芽細胞様の細いかたちをとりました。これらのかたちの表現型は、増加に対しては特異抗体の使用、減少に対しては精製したタンパク質を細胞に直接注入した結果、野生型にもどることから、かたちの変化がαBの多寡によることを証明できました。またαBはモータータンパク質でも細胞骨格タンパク質でもなく、タンパク質の形のお世話をする分子シャペロンですが、発現を減少させると、本来ほとんど移動しないはずの細胞が足の支持点を失い尺取り虫のように移動してしまいました。安定な細胞接着のために分子シャペロンが必要であることを示したのは本論文がはじめてです。αBの多寡による特徴的なかたちと挙動のメカニズムには、細胞の足である接着斑タンパク質のひとつビンキュリンが関わっていることも明らかにしました。
生命体は、環境の様々なストレスのなかでひたすら生き残るためのシステムを開発してきましたが、ストレスタンパク質の基本的な生命システムにおける重要性については理解が乏しいのが現状です。私達の日々の活動は、図2にあるように遺伝子情報を「活動依存性」に読み出してタンパク質をつくることです。これをDNAの二重らせんを発見した一人ワトソンは、この情報の一方方向の流れを「セントラルドグマ」と名付けました。私たちが生きるとは、逆転写酵素をもつウイルスは別として、この中心定理を駆動し続けることです。しかしこの図に示したように、細胞はストレスがない通常の状態でも30%もの高率で間違いを起こしています。間違っても元に戻せるものは戻し、戻せないものは分解するという細胞の現場におけるタンパク質の合成と分解の循環を回し続けることが、実際、アルツハイマー病などの高齢者で増加する神経疾患の予防の鍵で、ストレスタンパク質の仲間を過剰に発現させた線虫C. elegansやマウスでは、寿命が延長することが明らかになっています(図3)。中でもsHSPsは、寿命の延長に貢献することが分かっています。その分子的なメカニズムは不明ですが、本研究がその背景のメカニズムを示唆している可能性もあります。
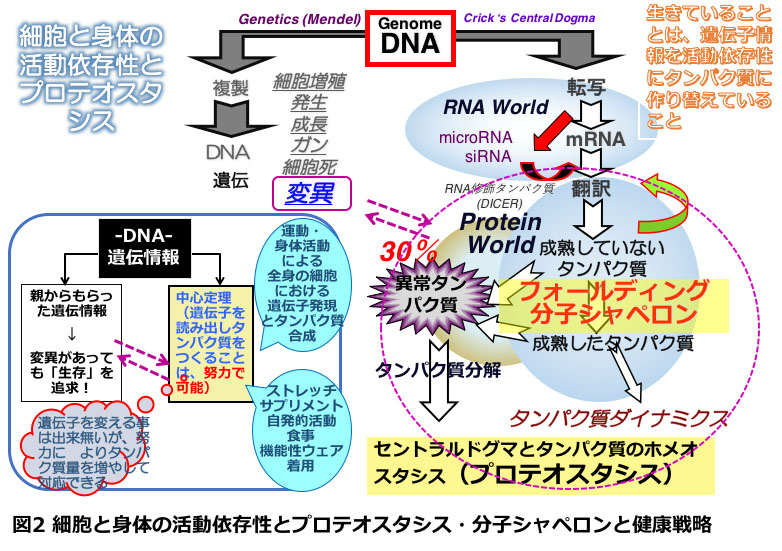
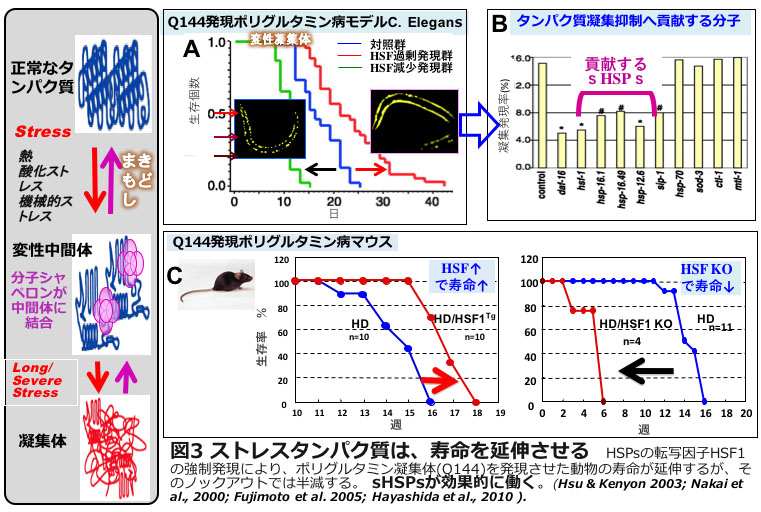
<今後の展開>
多細胞動物の生命体が、受精後、たった一個の細胞から発生・分化・形態形成プロセスについては研究が進みましたが、生まれたあと、100年という長い時間を病気にならずに生き続けるための健康戦略が必要で、アルツハイマーやパーキンソン、多発性硬化症、心筋梗塞などの疾病に効果的なαBがその鍵になると期待できます。
◆本研究に関する問い合わせ◆
東京農工大学大学院工学研究院有機材料科学・材料健康科学寄付講座
客員教授
跡見順子(あとみよりこ)
TEL/FAX: 042-388-7539
電子メール:yatomi(ここに@を入れて下さい)cc.tuat.ac.jp
