化学合成と酵素合成のハイブリッド化が拓く天然物合成の新展開〜制ガン活性を発現する多環性アルカロイド群の系統的迅速合成〜
化学合成と酵素合成のハイブリッド化が拓く天然物合成の新展開
〜制ガン活性を発現する多環性アルカロイド群の系統的迅速合成〜
東京農工大学大学院工学研究院応用化学部門の大栗博毅教授、生命機能科学部門の浅野竜太郎准教授、北海道大学大学院理学研究院化学部門の及川英秋教授、南篤志准教授らは、酵素合成と化学合成を融合し、制ガン活性をもつ多環性アルカロイド群を柔軟に迅速合成するハイブリッドプロセスを開発しました。酵素変換で得られる中間体を単離せずに連続的に官能基を変換し、化学合成したシンプルな基質から複雑な五環性母骨格をわずか一日で合成することに成功しました。更に2〜3工程の化学変換を施して、ジョルナマイシン、サフラマイシン類の系統的な全合成に成功しました。
本研究成果は、アメリカ化学会 Journal of American Chemical Society(8月16日付)のオンライン版に公開されました。
論文タイトル: Chemo-enzymatic Total Syntheses of Jorunnamycin A, Saframycin A, and N-Fmoc Saframycin Y3 (化学ー酵素ハイブリッドプロセスによるジョルナマイシン A、サフラマイシンA、サフラマイシンY3誘導体の全合成)
URL:https://pubs.acs.org/doi/10.1021/jacs.8b07161
現状
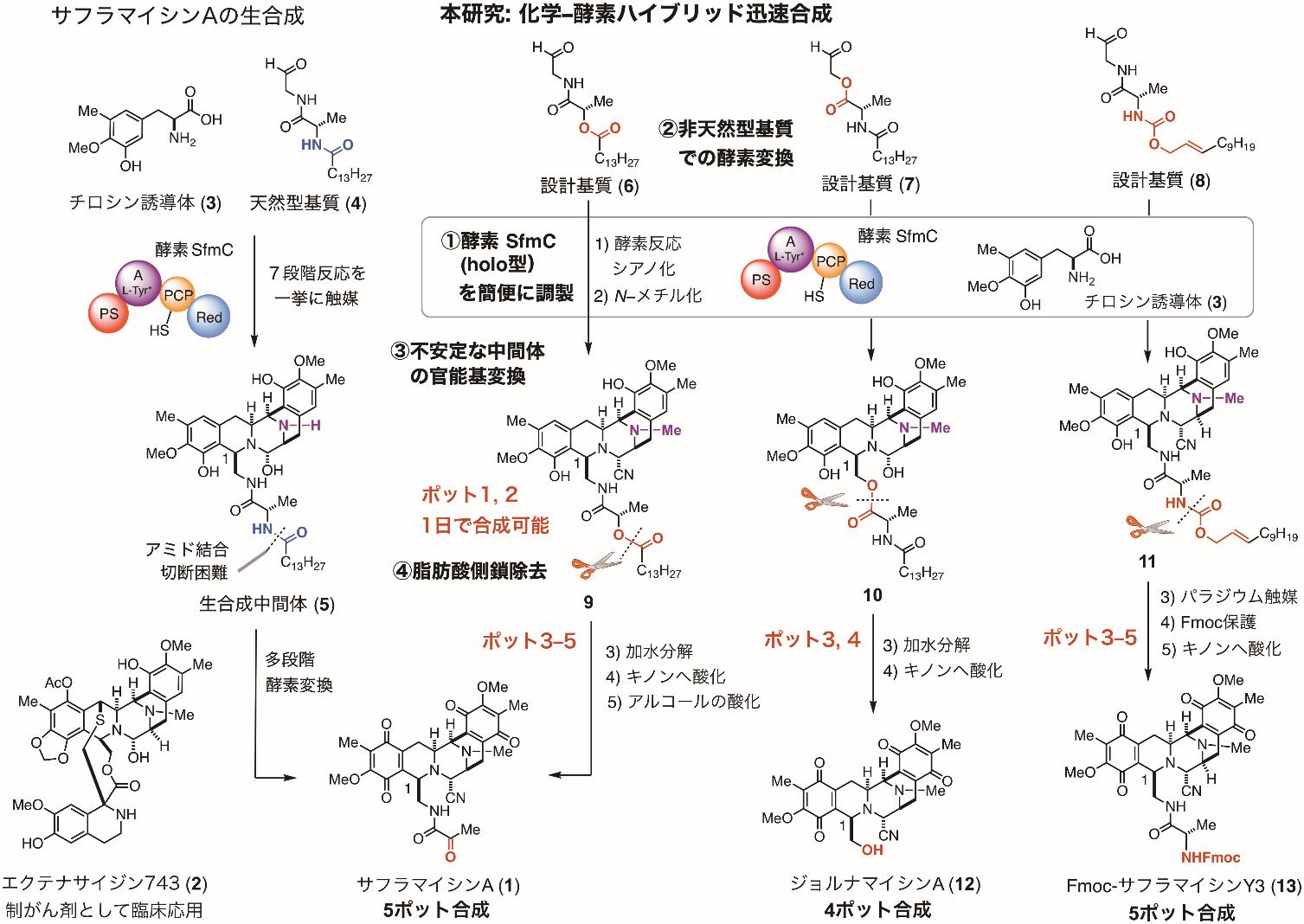
複雑な五環性骨格を持つサフラマイシン類 (1) は、強力な抗腫瘍活性を発揮します。ほぼ同一の母骨格を共有するエクテナサイジン類 (2) はユニークな作用メカニズムを有する制がん薬として実際に臨床応用されています。これらアルカロイド(窒素を有する天然有機化合物)は、革新的な創薬候補分子群として注目されていますが、人工合成による供給が障壁となっています。1982年にサフラマイシンBの合成が達成されて以来、関連するアルカロイド群の合成が活発に検討されてきました。しかし、繊細な官能基が組み込まれた五環性母骨格は、10工程以上の多段階を経て化学合成する必要がありました。一方当研究グループでは、非リボソーム依存型ペプチド合成酵素であるSfmCが単純な2つの基質 (3, 4) を順次連結し、五環性母骨格 (5) を一挙に生合成する機構を明らかにしていました(2010年 Nat. Chem. Biol. 誌、図の左側「サフラマイシンAの生合成」を参照)。しかし、アルカロイド(1, 12) やその誘導体を合成するには解決すべき課題[①酵素の簡便な調製、②非天然型基質での酵素変換、③不安定な中間体の官能基変換、④酵素反応に不可欠な脂肪酸側鎖の除去等]が山積している状況でした。
研究体制
本研究は、東京農工大学大学院工学研究院応用化学部門の博士後期課程大学院生 谷藤 涼(日本学術振興会特別研究員DC1)、大栗博毅教授、東京農工大学大学院工学研究院生命機能科学部門の浅野竜太郎准教授、北海道大学大学院理学研究院化学部門の南篤志准教授、及川英秋教授らによって実施されました。本研究はJST さきがけ(分子技術と新機能創出)、科学研究費補助金 基盤研究(A) JP15H01835、基盤研究(B) JP16H06446、新学術領域研究(生合成リデザイン)JP17H05433、日本学術振興会特別研究員奨励費 JP17J00931、第一三共生命科学研究振興財団、長瀬科学技術振興財団の助成を受けて行われました。
研究成果
本研究では、酵素SfmCによる多環性骨格構築と官能基を変換する化学合成を融合させたハイブリッドプロセスを開発しました。まず、①酵素の簡便な調製法を確立し、②酵素に受容される非天然型基質群を設計・化学合成して、基質の構造と酵素活性との相関を把握しました。天然型基質 (4) では、酵素反応に必須な長鎖脂肪酸がアミド結合で連結しているため、酵素反応後の切断が困難でした[生合成中間体 (5)]。そこで、長鎖脂肪酸部位を確実に切断し、1位側鎖の官能基が異なる三系統のアルカロイドを自在に迅速合成するため、アミドの代わりにエステルやアリルカルバメートを導入した基質群 (6–8) を設計しました。簡便に化学合成した設計基質群 (6–8) に酵素 SfmC を作用させ7連続反応を進行させた後、同じ反応容器内でシアノ化しました。更に、③不安定な中間体を単離せずにそのままN-メチル化する手法を開発し、適切に官能化された五環性母骨格 (9–11) を僅か一日で再現性良く合成することに成功しました。④非天然型基質群に組み込んだエステルやアリルカルバメートを活用して脂肪酸側鎖を除去した後、1〜2 段階の化学変換を施し、制ガン活性を有するアルカロイド群[サフラマイシンA (1)、ジョルナマイシンA (12)、サフラマイシン Y3 の窒素保護体(13)]を系統的に迅速合成できることを実証しました。今回開発した化学―酵素ハイブリッドプロセスにより、シンプルな基質群 (3, 6–8) から僅か 4〜5 ポットの変換で、多数の官能基を持つ複雑な多環性アルカロイド群を作り分けられるようになりました。
今後の展開
化学合成と酵素合成を融合したプロセスは少なく、酵素反応で官能基を変換する例[リパーゼによる加水分解/アシル化やチトクロームP450による酸化]にほぼ限定されていました。これに対し本研究では、化学合成とIn Vitro酵素合成を融合させ、多官能性のアルカロイド骨格を簡便に構築できるハイブリッドプロセスを実現しました。中間体を単離せずに、シンプルな基質群から複雑な縮環骨格を迅速合成(<1日)できるIn Vitro酵素変換の長所と基質/中間体の構造や反応性を合理的に設計・最適化できる有機合成化学の利点を相乗的に活かすことができるのが特徴です。複雑な生物活性分子群を人工的に創出する環境調和型の次世代創薬基盤技術として、今後の発展が期待されます。
◆研究に関する問い合わせ◆
東京農工大学大学院工学研究院
応用化学部門 教授
大栗 博毅(おおぐり ひろき)
TEL/FAX: 042-388-7037
E-mail: h_oguri(ここに@を入れてください)cc.tuat.ac.jp
北海道大学大学院理学研究院
化学部門 教授
及川 英秋(おいかわ ひであき)
TEL: 011-706-2622
E-mail: hoik(ここに@を入れてください)sci.hokudai.ac.jp
◆報道に関する問い合わせ◆
東京農工大学総務部総務課広報・基金室
TEL: 042-367-5930
E-mail: koho2(ここに@を入れてください)cc.tuat.ac.jp
北海道大学総務企画部広報課
TEL: 011-706-2610
E-mail: kouhou(ここに@を入れてください)jimu.hokudai.ac.jp
