悪性黒色腫(メラノーマ)が細胞死を起こさずに増殖する分子機構を解明
悪性黒色腫(メラノーマ)が細胞死を起こさずに増殖する分子機構を解明
国立大学法人東京農工大学農学府の石川英明特任助教・泉川桂一特任助教及び高橋信弘特任教授は、ベルギー KU-Leven Laboratory for RNA cancer biologyのLeucci Eleonora博士らのグループとの国際共同研究で、悪性黒色腫(メラノーマ)細胞が特定のRNAを使い細胞増殖を昂進するこれまでに知られていなかった発症機序を解明しました。この成果により、悪性度が極めて高い腫瘍であるメラノーマに対して、今までとは異なる標的を狙ったまったく新しい治療法開発に繋がることが期待されます。
本研究成果は、Nature Structural & Molecular Biology誌(10月29日付)に掲載されます。
報道解禁日:2018年10月30日 午前1時(日本時間)
URL:https://doi.org/10.1038/s41594-018-0143-4
悪性黒色腫(メラノーマ)は日本人では十万人に数人ですが、白色人種では日本人の10倍程度の高い頻度で発症し、オゾンホールの拡大による紫外線量の増加などによりその頻度は年々増加しています。メラノーマは、皮膚癌として良く知られていますが、様々な組織で起こり、発症初期は主に外科的に切除されます。進行に伴い化学療法・免疫療法・放射線治療等が併用されて行われますが、最近、メラノーマ細胞に応答する免疫細胞をターゲットとした抗体医薬による治療も行われるようになりました。従来に比べるとより有効な治療が行われつつありますが、多くの場合悪性度が高くその効果は限定的であり、また抗体医薬品は高価であるために治療費の高騰を招いています。本研究は、科学技術振興機構による戦略的創造研究推進事業[研究領域「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」の研究課題「RNA代謝異常症のリボヌクレオプロテオミクス解析と構造生命科学への展開」(礒辺俊明代表)]の一環として、東京農工大学農学府の石川英明特任助教・泉川桂一特任助教及び高橋信弘特任教授らのグループとベルギーKU-Leven Laboratory for RNA Cancer BiologyのLeucci Eleonora博士らのグループとの国際共同研究として実施されたものです。
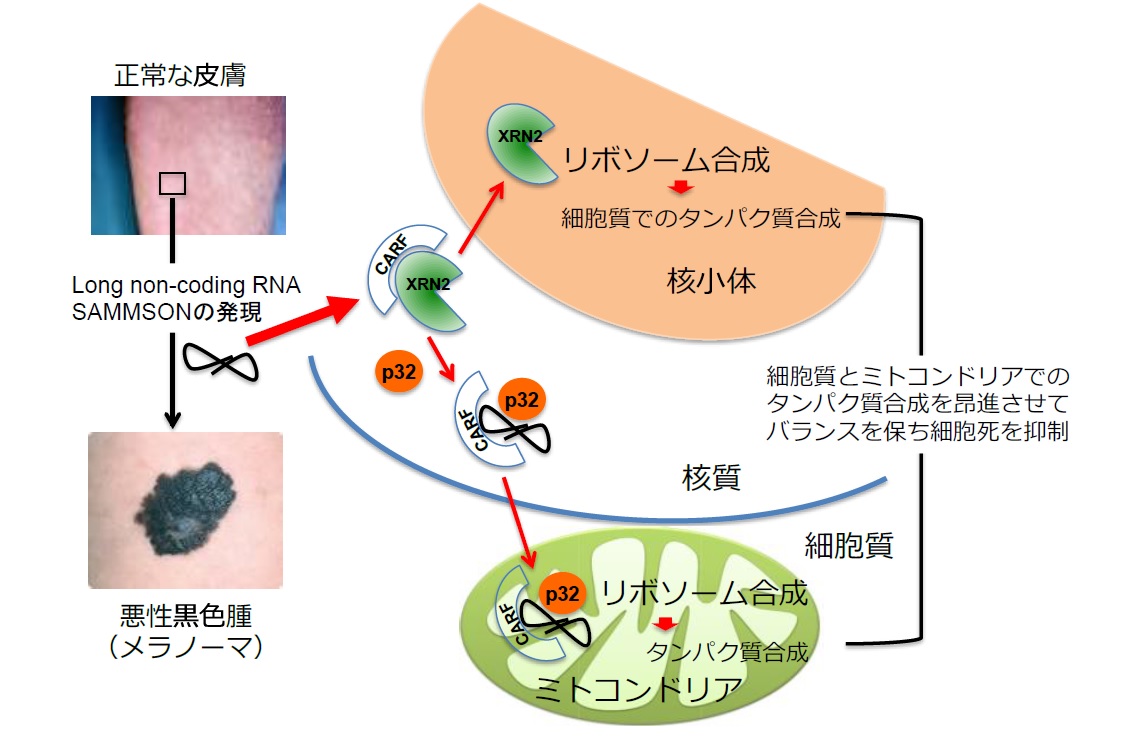
本研究の成果は、2つの主要な発見が結びついて得られたものです。第一の発見は、東京農工大学のグループが様々なRNA(核酸)とタンパク質が形成する複合体を解析する中で、癌抑制因子(ARF)と結合し細胞増殖や老化を制御するCARF(Collaborator of ARF)というタンパク質が、タンパク質を合成する装置であるリボソームの合成注1)を促進するXRN2という酵素を、リボソーム合成の場である核小体とは違う場所の核質に留めて、リボソーム合成を押さえているとの発見です(Sato & Ishikawaら、Nucleic Acids Research 2015 43:10397-10410)。第二の発見は、ベルギー KU-Levenのグループがタンパク質合成に使われない長いRNA(long non-coding RNA)注2)の一種でSAMMSONと命名されたRNAが90%以上の皮膚のメラノーマに特異的に存在し、これがp32と呼ばれるタンパク質をミトコンドリア注3)に運びそこでのタンパク質合成の増加とミトコンドリアの活性を昂進させるとの発見です(Leucciら、Nature 2016 531;518–522)。そして、SAMMSONがCARFに結合するとの知見をきっかけとして国際共同研究が進められた結果、1)核質でのCARF-XRN2結合においてSAMMSONはXRN2と競合する事でCARFを奪い取りXRN2を放出させる、2)放出されたXRN2は核質から核小体に入りそこでリボソーム生合成を昂進させる、一方、3)CARFを奪い取ったSAMMSONはp32との結合を増加させミトコンドリアに移行する、4)CARF-SAMMSON-p32はミトコンドリアのリボソーム合成を促進させることを見いだしました。即ち、皮膚のメラノーマ細胞では、SAMMSONを使って、正常細胞で抑制制御されている核小体でのリボソーム合成とミトコンドリアでのリボソーム合成の両方を昂進させ細胞質とミトコンドリアでのタンパク質合成のバランスを取って細胞死を誘導させること無く増殖を昂進させていることが明らかになりました(図)。
リボソーム合成はほぼ全ての細胞が増殖し生存するためには必須であり、増殖の際に細胞が必要とする全物質と全エネルギーの約80%をリボソーム合成だけに費やします。特に癌細胞が増殖するためにはリボソーム合成をそれに見合っただけ昂進させなければなりませんが、リボソーム合成をただ昂進させても、細胞はその異常を感知して細胞死を誘導させる機構を持っています。その細胞死の多くはミトコンドリアによって制御されていますが、メラノーマの場合には、SAMMSONが核小体とミトコンドリアでのリボソーム合成のアンバランスを解消し細胞死を防いでいると考えられます。従って、SAMMSON-CARFを介した働きを抑える物質は、メラノーマの新しい治療薬になり得ると考えられます。SAMMSONあるいはCARFの働きを押さえる物質の探索によって、新しい発症機序に基づいた治療薬の開発が期待されます。
注1) リボソームの合成は、細胞の小器官である核の中心部に存在する核小体で行われます。核小体にはリボソームを構成するRNA(リボソームRNA)の遺伝子が数百コピー存在し、通常はそのおよそ半分の数の遺伝子からリボソームRNAが合成されます。リボソームRNAは、細胞が合成しているRNAのおよそ80%を占めています。リボソームの合成は、約80種のリボソームタンパク質の他に、合成を補助するRNAとタンパク質それぞれ数百種類が関わり非常に複雑な工程を経て行われます。
注2) long non-coding RNAは、メッセンジャーRNAと異なりタンパク質合成の鋳型にならないRNA で、非常に沢山の種類が存在しますが、その一部を除き細胞内での機能がほとんど不明です。
注3) ミトコンドリアは、細胞質に2000個ほど存在する細胞内小器官で、酸素を使って細胞のエネルギー源であるATPを合成します。ミトコンドリア独自のゲノムを持っており、そのゲノムからATPを合成するために必要な酵素の鋳型となるメッセンジャーRNA、トランスファーRNA、リボソームRNAを合成し、核ゲノムにコードされたRNAとタンパク質もミトコンドリア内に取り入れ、独自のタンパク質合成を行っています。ミトコンドリアは、細胞の異常を感知すると細胞死を誘導するシグナルを出す働きもあります。
◆研究に関する問い合わせ◆
東京農工大学農学府
特任助教 石川英明(いしかわ ひであき)
電話番号:042-367-5703 メールアドレス:hideishi(ここに@を入れてください)cc.tuat.ac.jp あるいは
特任教授 高橋信弘(たかはしのぶひろ)
電話番号:042-367-5709 メールアドレス:ntakahas(ここに@を入れてください)cc.tuat.ac.jp
関連リンク(別ウィンドウで開きます)
- 東京農工大学 高橋信弘特任教授 研究室WEBサイト
- 石川英明特任助教・泉川桂一特任助教及び高橋信弘特任教授が所属する 東京農工大学大学院農学府
- 「EurekAlert!」へのリンク~悪性黒色腫(メラノーマ)が細胞死を起こさずに増殖する 分子機構を解明~
