〔2016年1月28日リリース〕ペプチド凝集の物理化学的起源を計算機シミュレーションにより解明
ペプチド凝集の物理化学的起源を計算機シミュレーションにより解明
~アルツハイマー病などの神経変性疾患の仕組みの解明につながることへの期待も~
東京農工大学大学院工学研究院・黒田研究室、理化学研究所生命システム研究センター・生命モデリングコア・泰地真弘人副センター長、及び日本大学・末永敦准教授らのグループは、理化学研究所で開発された分子動力学(MD)シミュレーション専用計算機 MDGRAPE-3を用いて、シミュレーションによってペプチドの凝集性(及び溶解性)を再現することに世界で初めて成功しました。この成果は、ペプチドやタンパク質からできているバイオ医薬品の設計において新たな指針を与えると期待されます。さらにタンパク質凝集が原因と考えられているアルツハイマー病や変異原性クロイツフェルト=ヤコブ病など、種々の神経変性疾患の仕組みの解明につながることが期待されます。
|
本研究成果は、Scientific Reports(1月28日付)に掲載されます。 報道解禁日:1月28日 19:00 |

図1:タンパク質の凝集:凝集した牛トリプシン阻害タンパク質(BPTI)試料を左に、アミノ酸置換によって溶解性を向上したBPTI試料を右に示す。
現状:近年、バイオ産業界において、低溶解性ペプチドが凝集し、目的の機能を発揮しないことがしばしば問題となっています。さらに、タンパク質やペプチドの凝集は、アミロイド線維という生体内凝集の形でアルツハイマー病や変異原性クロイツフェルト=ヤコブ病など、種々の神経変性疾患の仕組みにも関連すると考えられている生物学的にも重要な現象です。これらのことから、タンパク質やペプチドの凝集過程の物理化学的な理解が求められてきました(図1)。しかし、高濃度分子の会合状態を実験的に解析することは困難で、研究はあまり進められていません。
現在、ペプチドやタンパク質は構成アミノ酸の疎水性の高いほうが凝集しやすいと考えられています。しかし、これは非極性有機溶媒と水溶性溶媒における分子の分配係数に基づいて1960年代から80年代に開発された簡易化された指標であり、厳密に分子の溶解性や凝集性を表すものではありません(図2;Nozaki &Tanford, J.Biol.Chem.,1972,など)。さらに、親水性・疎水性は経験的に求められた一種の指標であり、分子の溶解性や凝集性を物理化学の第一原理から解明するための理論やモデルが必要とされていました。
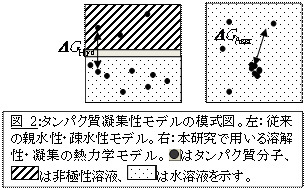

図3:理化学研究所開発の分子動力学シミュレーション計算専用計算機 MD-GRAPE 3。
研究体制:本研究は、東京農工大学(黒田裕准教授及び大学院生の小須田慧司氏と佐藤雄士氏)、理化学研究所生命システム研究センター(泰地真弘人副センター長)及び日本大学(末永敦准教授)の共同研究として、理化学研究所で開発されたMDシミュレーション計算専用計算機 MDGRAPE-3(図3)を用い、JSPS科研費の助成を受けて行われました。
研究成果:システインとグリシンを除いた18種類のアミノ酸の凝集性(及び溶解性)を、全原子MDシミュレーション(AMBER8ソフトウエア)を用いて計算しました。具体的には、同一アミノ酸から成る4残基のペプチドを27及び54個、一辺が10nm(1nm=10億分の1メートル)の立方体に配置し(5g~10g/L 相当)、周期境界条件を用いて温度303K(30 ℃)で100ns(1ns=10億分の1秒)のシミュレーションを行いました。MDシミュレーション専用機であるMDGRAPE-3を用いたことで、大量の計算を約5カ月で終えることができました。
MDシミュレーションからペプチド間距離及び会合体数などの指標を経時的に解析し、凝集性及び溶解性の相対的な値を求め、実験値と比較した結果、ペプチドの会合体の平均サイズとアミノ酸の親水性・疎水性指標に相関があることを解明しました(図4)。また、アルギニンやリシンを含む電荷を有するアミノ酸の溶解性の高さは分子の静電的な反発が原因であり、ロイシンやイソロイシンなどの疎水性の高いアミノ酸からなるペプチドの凝集は分子間力(Van der Waals相互作用)によることが本研究により明らかとなりました。さらに、アラニンからなるペプチドは低濃度では凝集せずに濃度の上昇とともに凝集したことから、凝集形成の濃度依存性も本計算で再現できることが示唆されました。
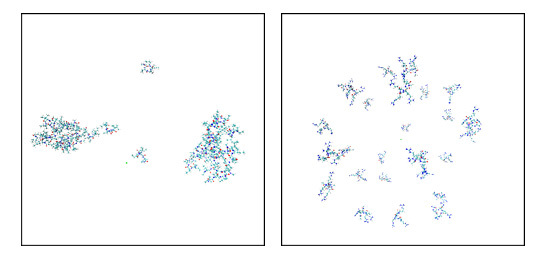
図4:MD計算10ns時点のスナップショット。27本のイソロイシンペプチド(左)の凝集、アルギニンペプチド(右)の溶解状態を示す。疎水性の高いイソロイシンのほうが明らかに凝集しやすい。
今後の展開:本研究では、計算量の多さから今まで行われてこなかった、複数のペプチドを含む系の全原子MDシミュレーションを用いたペプチド凝集形成の系統的解析を初めて実現しました。今後は本研究成果を生体内凝集の一種、アルツハイマー病に代表される神経変性疾患との関係が示唆されるアミロイド線維に応用したいと考えています (Ross CA,Nature Med 2004)。従来のシミュレーションでは、初めからアミロイド線維構造に配置した少数のペプチドの動向を計算するのが限界でした。一方、本計画ではランダムに配置した多数のペプチドが分離状態からアミロイド線維構造へ会合する過程を調べることで、その機構の詳細な解明を目指します。この様な大規模な計算にも関わらず、MDシミュレーション専用機を用いることで、数カ月で終了するため、アミロイド線維構造への凝集の「計算機実験」が世界で初めて可能になると期待されます(なお、計算規模と解析条件が限られた報告として、Lakshman et al, PNAS 2013が挙げられます)。
【用語解説】
分子動力学(MD)シミュレーション:原子の動きを古典力学におけるニュートンの運動方程式を数値的に解くことによって再現するシミュレーション法である。この系では、分子間に働く相互作用を原子間力学力場によって定義する。現在、MD法は、材料科学、バイオ等の分野で広く適用されている。MDはMolecular Dynamicsの略。
