過酷な環境下でも利用可能な堅牢性リン脂質マイクロチューブの開発に成功 ―細胞内を模倣した環境で膜結合タンパク質の on tube 定量解析を実現―
過酷な環境下でも利用可能な堅牢性リン脂質マイクロチューブの開発に成功
―細胞内を模倣した環境で膜結合タンパク質の on tube 定量解析を実現―
ポイント
- リン脂質が集合して作られる脂質膜は、膜タンパク質を固定する足場材料として分子生物学研究で広く用いられ、その機能評価に貢献しています。特に膜結合タンパク質注1)の機能解明のためには、それを固定するチューブ状の足場材料が必要ですが、安定なリン脂質マイクロチューブ材料はこれまで構築されていませんでした。このことが、膜結合タンパク質の機能解明におけるボトルネックとなっていました。
- 本研究では、膜相分離注2)を起こすリン脂質膜上で、独自に開発したカチオン性ペプチド脂質(PCaL)を集合させることで、酸性・塩基性条件、高温、高塩濃度、高浸透圧条件下、夾雑(きょうざつ)環境注3)下、光ピンセット注4)による物理的な引っ張りなど、いずれの過酷な環境下においても構造を維持する高い堅牢(けんろう)性を持つリン脂質マイクロチューブPMTPCaLの開発に成功しました。
- PMTPCaLを、膜結合タンパク質の一つであるSNX1注5)の足場として利用し機能評価を行った結果、SNX1は、細胞内を模倣した夾雑環境下において、非夾雑環境下に比べてより強く膜と結合することを明らかにしました。
- 膜結合タンパク質は、膜の構造維持や膜輸送、シグナル伝達などの生命機能の根幹をなす機能に不可欠な生体分子で、その機能不全は、細胞の機能異常を引き起こすとともに、神経変性疾患の一因になっていると考えられています。高い堅牢性を持つPMTPCaLは、膜結合タンパク質の機能や特性を、チューブ上(on tube)で、光ピンセットなどを用いて直接かつ定量的に評価するための革新的な材料として今後利用され、膜結合タンパク質の機能解明と、さらにはそれが関連する疾患の理解と治療方法の開発に広く貢献すると期待されます。
本研究成果は、2025年10月23日、アメリカ化学会誌「Journal of the American Chemical Society」のオンライン版で公開されました。
論文タイトル:A Structurally Robust Phospholipid Microtube Constructed by Membrane Phase Separation as a Scaffold for On-Tube Characterization of Membrane-Bound Proteins
著者:Noriyuki Uchida, Ryu Ishizaka, Anju Kawakita, Hiroshi Ueno, Hiroyuki Noji, Rinshi S. Kasai, Takeshi Yokoyama, Saburo Kurihara, Tomoki Noguchi, Go Watanabe, Ayaka Iwasaki, Itsuki Ajiokai, Kazuyoshi Muranishi, Ken Yoshizawa, Shingo Kanemura, Masaki Okumura, Takahiro Muraoka
*責任著者:内田紀之、村岡貴博
URL:https://pubs.acs.org/doi/10.1021/jacs.5c13384
概要
東京農工大学大学院工学府の石坂龍(博士前期課程修了)、河北杏樹(博士前期課程修了)、岩崎彩花(博士前期課程)、吉澤憲(博士後期課程修了)、同大学院工学研究院応用化学部門の村西和佳特任助教、内田紀之特任講師、村岡貴博教授、東京大学大学院工学系研究科応用化学専攻の上野博史講師、野地博行教授、国立がん研究センター先端バイオイメージング研究分野の笠井倫志ユニット長、東京科学大学総合研究院脳統合機能研究センターの味岡逸樹教授、北里大学大学院理学研究科生物科学専攻の栗原三朗(修士課程修了)、同大学大学院未来工学研究科生命データサイエンス専攻の野口智希(修士課程)、同大学未来工学部データサイエンス学科の渡辺豪教授、東北大学大学院生命科学研究科の横山武司助教、同大学学際科学フロンティア研究所の金村進吾助教、奥村正樹国際卓越准教授の研究グループは、過酷な外部環境下において構造を安定に維持する堅牢性リン脂質マイクロチューブPMTPCaLの開発に成功しました。
PMTPCaLは、膜相分離を起こすリン脂質膜上でPCaLを集合させることで構築されました。PMTPCaLは、酸性・塩基性条件、高温、高塩濃度、高浸透圧条件下、夾雑環境下、光ピンセットによる物理的な引っ張りなどの過酷な環境下においても、極めて高い構造安定性を持ちます。PMTPCaLを膜結合タンパク質の一つであるSNX1タンパク質の足場として利用し、その吸着挙動を評価した結果、細胞内を模倣した夾雑環境下においては、非夾雑環境下に比べ、SNX1タンパク質のリン脂質マイクロチューブに対する結合が増強されることを明らかにしました。この高い堅牢性を持つPMTPCaLは、将来的には、様々な膜結合タンパク質の機能や特性をチューブ上(on tube)で、光ピンセットなどを用いて直接かつ定量的に評価するための革新的な材料として利用され、膜結合タンパク質の機能解明に広く貢献すると期待されます。
背景
小胞体注6)や神経突起注7)に見られるリン脂質マイクロチューブは、膜結合タンパク質の足場として働く重要な構造体です。これまでに、生体分子モーター注8)や電場などの外部刺激を用いる方法によって、人工的なリン脂質マイクロチューブが作成されてきました。しかし、これまでに構築された人工リン脂質マイクロチューブは、いずれも熱力学的に不安定であり、その不安定性から生物学研究への応用が限定的でした。
研究の内容と成果
不飽和脂質注9)である1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン(DOPC)、飽和脂質注10)である1,2-ジパルミトイル-sn-グリセロ-3-ホスホコリン(DPPC)、およびコレステロール(Chol)からなる三脂質系は、脂質二分子膜を形成します。この脂質二分子膜は、DOPCを多く含む低秩序相(Ld)領域と、DPPCを多く含む高秩序相(Lo)領域の間で分離した、膜相分離を生じます。ここで一般的に、膜相分離形成によって膜変形が駆動されることが知られています。本研究では、DOPC/DPPC/Chol三脂質系を基盤に、膜相分離を制御し膜変形を誘起することを目指し、テトラリシンを結合させたカチオン性脂質PCaLと、テトラアスパラギン酸から成るアニオン性リガンドAsp4を設計しました(図1a)。
位相差顕微鏡観察から、DOPC/DPPC/Chol三脂質系にPCaLを混合すると、球状の脂質集合体が形成されることが示されました(図1b、図2a)。ここにAsp4を添加すると、脂質集合体が大きく変形し、リン脂質マイクロチューブPMTPCaLが自発的に形成されました(図1b、図2b–f)。変形後の構造体が中空構造であることは、共焦点顕微鏡観察(図2g)、クライオ透過型電子顕微鏡観察注11)(図2h)によって明らかになりました。DPPC/DOPC/Chol/PCaLの四成分脂質膜に対して、Asp4を添加した際のPCaLの膜中での分布と、膜相分離形成を原子間力顕微鏡注12)、および分子動力学(MD)計算注13)によって評価しました。その結果、Asp4添加前はPCaLは膜中で分散して存在し、膜全体では膜相分離は形成されていませんでした。それに対してAsp4添加後は、PCaLが膜中で自己集合するとともに、膜相分離が形成されていることが確認されました。膜相分離によって、PMTPCaLが自発的に形成されたと考えられます。
次に、生物学研究における、膜結合タンパク質の足場材料としてのPMTPCaLの応用を指向し、外部環境に対する耐久性を評価しました。従来のリン脂質マイクロチューブは、生体分子モーターや光ピンセットを用いて作られてきましたが、いずれも、チューブ形状を維持するためには、化学・物理的なエネルギーを加え続ける必要があり、外部エネルギーが消失するとチューブ形状が崩壊する脆弱なものでした。また、高温下や高浸透圧下、そして夾雑環境下などでも構造維持が困難であり、この構造の脆弱性が、これらの条件で行われる生物学研究への応用を阻む大きな要因となっていました。驚くべきことに、PMTPCaLは、酸性・塩基性条件、高温、高塩濃度、高浸透圧条件下、夾雑環境下など、いずれの過酷な環境下においても構造を長時間維持し、高い堅牢性を持つことが明らかになりました(図2i–q)。PMTPCaLの物性をさらに評価するため、膜結合タンパク質の一つSNX1で表面修飾したポリスチレンマイクロビーズをPMTPCaL上に吸着させ、光ピンセットを用いて、PMTPCaLの長軸方向、および垂直方向へマイクロチューブを引っ張る実験を行いました(図3a–c)。その結果、大変興味深いことに、マイクロチューブの長軸方向へはビーズはなめらかに移動するのに対し(図3d–f)、垂直方向へ引っ張った場合はマイクロチューブが湾曲し、ビーズが乖離すると同時にマイクロチューブが直線形に戻るという(図3g–i)、弾性的な挙動が観察されました。物理解析から、チューブが0.92 pNを超える復元力を持つことが算出されました。従来のリン脂質マイクロチューブは非弾性的な構造であることから、この弾性的な性質はPMTPCaLのユニークな特徴であると考えられます。
堅牢な構造である特徴を活かして、PMTPCaLを膜結合タンパク質SNX1の足場として利用し、その機能評価を行いました。蛍光ラベル化されたSNX1を作成し、夾雑物を含まない緩衝液条件と、細胞内の夾雑環境を模倣した、高濃度のポリエチレングリコール(PEG)を含む条件での、SNX1のPMTPCaLに対する結合挙動を比較しました(図4a)。共焦点顕微鏡観察を行ったところ、非夾雑環境下に比べて、長鎖PEGが含まれる夾雑環境下では、PMTPCaLに結合したSNX1に由来する蛍光が強く観察されました(図4b–h)。この結果は、SNX1のリン脂質マイクロチューブに対する結合力が、排除体積効果注14)の影響で、増強されることを示唆しています。SNX1とPMTPCaLとの結合力は、解離定数でKd < 2.2 μMと算出されました。細胞内で、SNX1は、ベシクルをリン脂質マイクロチューブへ変換するエンドソーム経路に関与することが知られています。夾雑環境下でリン脂質マイクロチューブと強く結合することは、SNX1が細胞内で効率的に機能するよう、生命進化の中でその構造が最適化されたと考えられます。
夾雑環境下でリン脂質マイクロチューブとの結合力を増強するSNX1の機能は、これまでの分子生物学研究では見出されてきませんでした。本研究で、堅牢なリン脂質マイクロチューブPMTPCaLの構築に初めて成功したことが、従来困難であった、細胞内類似環境下での膜結合タンパク質の定量的な機能評価を可能にすることを実証しました。
今後の展開
本研究で構築した堅牢なリン脂質マイクロチューブPMTPCaLは、球体(リポソーム)、円盤(バイセル)に継ぐ、第三のリン脂質集合体材料と位置付けられます。チューブ構造は、高い曲率を持つとともに長く伸長した構造であることから、基本的に浮遊性のリポソームやバイセルに比べて位置を固定できる特性を持ちます。従って、膜結合タンパク質などを、様々な環境下で長時間経時観察する上で有用です。
PMTPCaLは、その大部分(>99 mol%)が天然脂質で構成されたリン脂質マイクロチューブであり、特別な装置を必要とせず、Asp4を添加する簡便な操作によって構築することができます。さらに、その優れた堅牢性から、PMTPCaLは膜結合タンパク質の足場材料として利用可能であり、定量的な機能評価に有用であることが実証されました。本研究が基盤となり、分子生物学研究で堅牢なリン脂質マイクロチューブの利用が広がることで、ダイナミン注15)やアクチン注16)など、重要な生命機能を担う膜結合タンパク質の機能解明が、今後発展することが期待されます。
研究体制
本研究は、東京農工大学大学院工学研究院応用化学部門の村岡貴博教授、東京大学大学院工学系研究科応用化学専攻の野地博行教授、国立がん研究センター先端バイオイメージング研究分野の笠井倫志ユニット長、東京科学大学総合研究院脳統合機能研究センターの味岡逸樹教授、北里大学大学院未来工学研究科生命データサイエンス専攻の渡辺豪教授、東北大学大学院生命科学研究科の横山武司助教、同大学学際科学フロンティア研究所の奥村正樹国際卓越准教授の研究グループが中心となって行われました。本成果は、科学技術振興機構(JST)創発的研究支援事業(課題番号:JPMJFR2122、研究代表者:村岡貴博)、JST戦略的創造研究推進事業CREST(課題番号:JPMJCR19S4、研究分担者:村岡貴博)、日本学術振興会科学研究費助成事業学術変革領域研究B(課題番号:JP21H05096、研究代表者:村岡貴博)、同事業基盤研究B(課題番号:JP25K01891、研究代表者:村岡貴博)、同事業基盤研究C(課題番号:JP23K04927、研究代表者:内田紀之)、国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)、官民による若手研究者発掘支援事業(課題番号:23W1M041、研究分担者:内田紀之)、一般財団法人キャノン財団(村岡貴博)、公益財団法人旭硝子財団(村岡貴博、内田紀之)、公益社団法人新化学技術推進協会(内田紀之)、一般財団法人守谷育英会(内田紀之)、一般財団法人田中貴金属記念財団(内田紀之)、公益財団法人コーセーコスメトロジー研究財団(内田紀之)、公益財団法人ロッテ財団(内田紀之)の支援を受けて得られました。
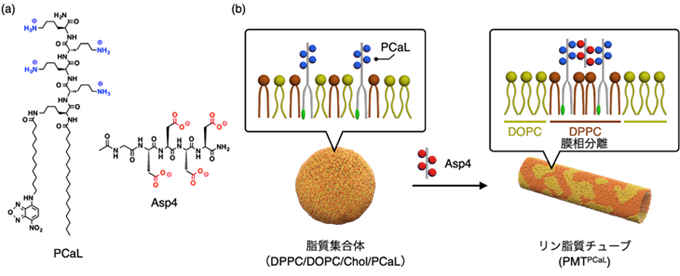
図1 (a) PCaLとAsp4の分子構造、(b) PCaLの集合により引き起こされる膜相分離とリン脂質マイクロチューブ(PMTPCaL)の形成の概略図。
DPPC/DOPC/Chol/PCaLからなる四成分膜にAsp4を添加すると、PCaLの集合化と共に膜相分離が誘導され、PMTPCaLが形成される。
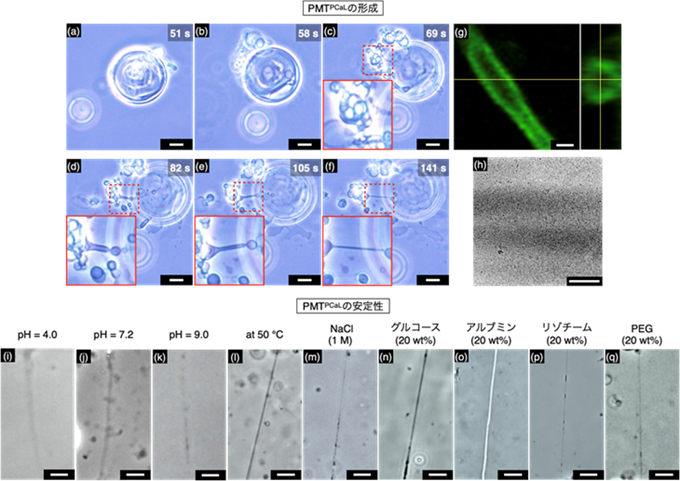
図2 (a–h) PMTPCaL形成における位相差顕微鏡観察画像 (a–f)、共焦点顕微鏡画像 (i,j)、および透過型電子顕微鏡画像 (h) (スケールバーはそれぞれ5 μm、1 μm、200 nm)。(i–o) pH変化 (i-k)、昇温 (l)、高塩濃度 (m)、浸透圧下 (n)、アルブミン共存下 (o)、リゾチーム共存下 (p)、PEG存在下 (q) において構造が維持されたPMTPCaLの位相差顕微鏡画像 (スケールバー: 100 μm)。
DPPC/DOPC/Chol/PCaLからなる脂質集合体([DOPC]/[DPPC]/[Chol]/[PCaL] = 40/40/20/1)にAsp4を添加することで、基盤上で中空構造を持ったPMTPCaLが、自発的かつ段階的に形成される(a–h)。PMTPCaLは、pH変化、高温、高塩濃度、高浸透圧条件下、夾雑環境下など様々な過酷な環境下でも構造を維持し、堅牢である(i–q)。
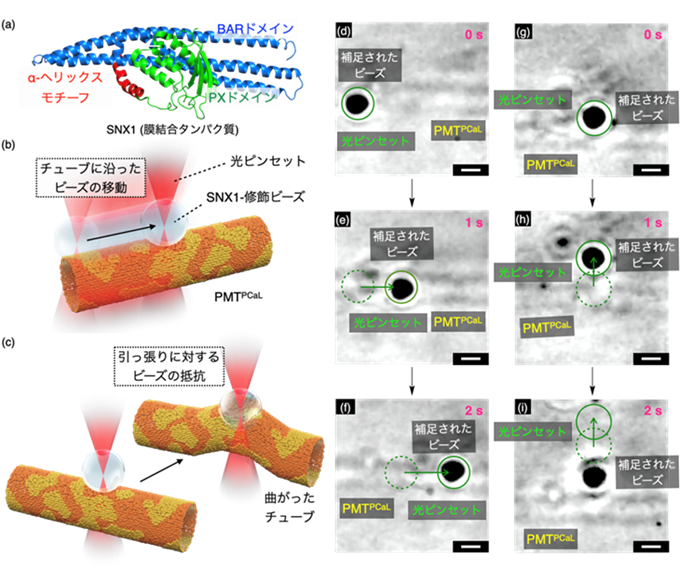
図3 (a) SNX1のリボン構造、BARドメイン (水色)、PXドメイン (緑)、α-ヘリックスモチーフ (赤) で構成される。(b, c) 光ピンセットを用いた、PMTPCaLに沿った長軸方向 (b) および垂直方向 (c) への、SNX1被覆ポリスチレンマイクロビーズの引っ張り試験の模式図。(d–i) PMTPCaL ([DOPC]/[DPPC]/[Chol]/[PCaL] = 40/40/20/1) に付着したSNX1コーティングマイクロビーズを光ピンセットを用いて長軸方向 (d–f) および垂直方向 (g–i) へ移動させた際の、引っ張り試験の明視野顕微鏡写真。スケールバー:2 μm。
膜に結合するSNX1で修飾されたマイクロビーズを作成した。PMTPCaLの性質を調べるため、PCaLにマイクロビーズを結合させ、光ピンセットを用いてマイクロビーズをPMTPCaLの長軸方向、および垂直方向に移動させた。長軸方向に移動させた場合、ビーズはなめらかに移動したのに対し、垂直方向に移動させた場合は、ビーズの移動ともにPMTPCaLが湾曲し、さらに移動させるとビーズが光ピンセットから乖離し、PMTPCaLも直線形に戻った。つまり、PMTPCaLが弾性的な特性を持つことが示された。
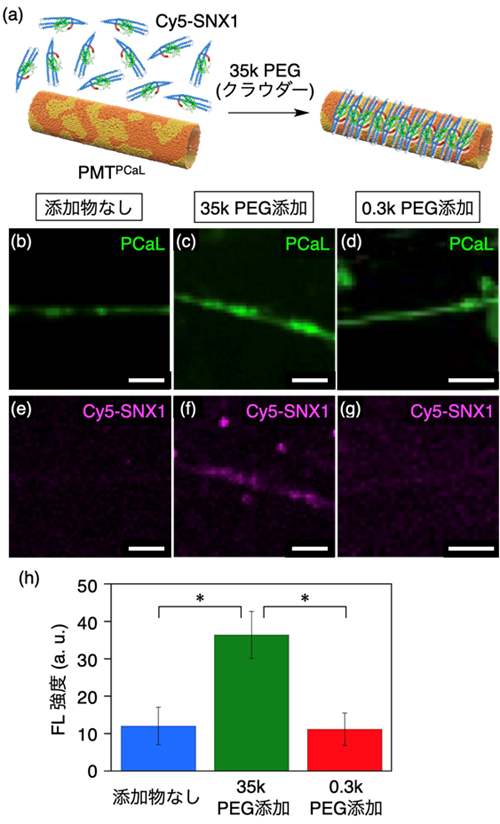
図4 (a) 蛍光ラベルしたSNX1 (Cy5-SNX1) のPMTPCaL上への結合の模式図。(b–g) 緩衝液中で、Cy5-SNX1 (1.4 μM) を加えた後のPMTPCaLの共焦点顕微鏡観察結果。添加物なし (b, e)、35k PEG (10 wt%) (c, f)) または0.3k PEG (10 wt%) (d, g) を添加した際の顕微鏡画像。PCaL (b–d、λex = 488 nm、緑) およびCy5-SNX1 (e–g、λex = 638 nm、マゼンタ) の局在を示す。スケールバー:5 μm。(h) PMTPCaL上のCy5-SNX1の蛍光強度 (青:添加物なし、緑:35k PEG (10 wt%) 添加、赤:0.3k PEG (10 wt%) 添加)。
細胞内を模倣した、PEGが含まれる夾雑環境下でのSNX1の膜結合特性を、PMTPCaLを足場として利用して調べた。その結果、SNX1は、夾雑物が含まれない条件に比べて、長鎖PEG(分子量:35000)が含まれる夾雑環境において、より強くPMTPCaLと結合することが示された。短鎖PEG(分子量:300の存在下では結合力の増強が見られなかったことから、高分子が共存することによる排除体積効果を主な要因として、SNX1の膜結合力の増強が見られたと考えられる。
用語解説
注1)膜結合タンパク質
細胞膜や細胞内小器官(小胞体、ゴルジ体、ミトコンドリアなど)の膜に結合して機能するタンパク質。膜を貫通した膜貫通タンパク質や、膜の片側に接着した膜タンパク質の両方を含む。
注2)膜相分離
リン脂質膜などにおいて、構成成分の組成や相互作用によって、性質の異なる複数の領域に二次元的に分離する現象。
注3)夾雑(きょうざつ)環境
細胞内で見られる、タンパク質や核酸などの水溶性高分子が高密度で存在した環境。フラスコ内での希薄環境とは異なる物理的・化学的特性が現れ、化学反応の加速または遅延や、分子認識の増強または阻害が見られる。
注4)光ピンセット
強く集光したレーザー光の「光圧(光が持つ運動量)」を利用して、微小な物体を捕まえて操る技術。「光でつまむ」ように見えることからこのように呼ばれる。
注5)SNX1
PXドメインとBARドメインからなり、ソーティングネキシンファミリーに属する膜結合タンパク質。膜タンパク質のリサイクル輸送に関わり、受容体の寿命やシグナル伝達に影響するほか、神経変性疾患やがんとの関連も研究されている。
注6)小胞体
真核細胞の中に存在する膜構造の細胞小器官で、タンパク質や脂質の合成・輸送などに関わる。
注7)神経突起
神経細胞(ニューロン)から伸びている突起の総称。長く突き出す構造を持ち、神経回路を作
る。
注8)生体分子モーター
ATPなどの化学エネルギーを使って機械的な運動を生み出すタンパク質の総称。細胞の中で「ナノスケールのモーター」として働き、輸送・運動・力発生などを担う。
注9)不飽和脂質
分子構造における疎水部の炭素鎖に二重結合を一つ以上持つ脂質のこと。
注10)飽和脂質
分子構造における疎水部の炭素鎖に二重結合が存在しない脂肪のこと。
注11)クライオ透過型電子顕微鏡
生体分子を凍結固定し、電子線を試料に照射して透過した電子をレンズで拡大して観察する顕微鏡。原子レベルの分解能で、細胞内での生体分子の構造解析が可能な観察手法。
注12)原子間力顕微鏡
カンチレバーと呼ばれる微小な針の先端と試料表面の間に働く原子間力を利用して、試料表面の形状や性質をナノメートル(10億分の1メートル)レベルの分解能で観察する顕微鏡。
注13)分子動力学計算
力学法則に基づき、原子の位置や速度の時間変化を追跡することで、物質の構造・性質・変化を計算し、分子や原子の運動をコンピュータ上で模擬的に再現するシミュレーション手法。
注14)排除体積効果
溶液中に高分子が高濃度で存在することで、他の分子が入り込めない体積が生じ、その結果、分子の挙動や平衡が変化する効果。
注15)ダイナミン
エンドサイトーシスや膜の切断に関わるタンパク質で、エネルギー源であるグアノシン三リン酸を加水分解することで機能する。
注16)アクチン
細胞骨格タンパク質の一つで、ファイバー上に自己集合して細胞の形態・運動・分裂・物質輸送などに深く関与する。エネルギー源であるアデノシン三リン酸の加水分解を利用して重合・脱重合を行う。
◆研究に関する問い合わせ◆
東京農工大学大学院工学研究院
応用化学部門 教授
村岡 貴博(むらおか たかひろ)
〒184-8588 東京都小金井市中町2-24-16
TEL:042-388-7052
E-mail:muraoka(ここに@を入れてください)go.tuat.ac.jp
◆報道に関する問い合わせ◆
東京農工大学 総務課広報室
TEL:042-367-5930
E-mail:koho2(ここに@を入れてください)cc.tuat.ac.jp
科学技術振興機構 広報課
TEL:03-5214-8404
E-mail:jstkoho(ここに@を入れてください)jst.go.jp
◆JST事業に関する問い合わせ◆
科学技術振興機構 創発的研究推進部
加藤 豪(かとう ごう)
TEL:03-5214-7276
E-mail:souhatsu-inquiry(ここに@を入れてください)jst.go.jp
関連リンク(別ウィンドウで開きます)
