G4結合タンパク質を分解する新分子「G4L-PROTAC」を開発 ~がんや感染症の新しい創薬アプローチに期待~
G4結合タンパク質を分解する新分子「G4L-PROTAC」を開発
~がんや感染症の新しい創薬アプローチに期待~
国立大学法人東京農工大学大学院工学府生命工学専攻の野原 玲奈氏(博士後期課程)、棚谷 優磨氏(博士前期課程)、Mohammad Jafar Sheikhi氏(博士研究員)、同大学院工学研究院生命機能科学部門の長澤 和夫教授、寺 正行准教授らは、米国ケント州立大学のPratiksha Chaudhary氏、Grinsun Sharma氏、Hanbin Mao教授との共同研究により、DNA・RNAの特殊構造であり、がんやウイルス感染症といった疾患に深く関わることが知られているグアニン四重鎖(G-quadruplex: G4) に結合したタンパク質を選択的に分解する新しい分子「G4L-PROTAC」を開発しました。この分子は、G4に結合したタンパク質をユビキチン・プロテアソーム系に導き分解させる仕組みを持ち、従来技術では困難だった「G4に結合した状態のタンパク質」の機能を直接調べることを可能にします。この技術は、がんやウイルス感染症の新しい治療法につながる可能性があり、社会的にも大きな波及効果が期待されます。
本研究成果は、Angewandte Chemie International Edition(10月5日付)に掲載されました。
論文タイトル:Degradation of G-Quadruplex-Binding Proteins by G4L-PROTAC via Quaternary Complex Formation
URL:https://onlinelibrary.wiley.com/doi/10.1002/anie.202515045
背景
DNAやRNAの一部には、グアニン塩基が四重に積み重なってできる「グアニン四重鎖(G-quadruplex, G4)」と呼ばれる特殊構造が存在します。この構造は、がんやウイルス感染症など多くの疾患に深く関わることが知られており、近年は遺伝子発現制御やゲノム安定性における重要性が注目されています。G4には多くのタンパク質が結合し、細胞機能を調節していますが、「G4に結合した状態」のタンパク質の役割を直接解析する方法はこれまで存在しませんでした。これがG4研究および創薬応用における大きな課題となっていました。
研究体制
本研究は、東京農工大学大学院工学研究院生命機能科学部門の寺 正行准教授、長澤 和夫教授、同大学院工学府生命工学専攻 野原 玲奈氏(博士後期課程)、棚谷 優磨氏(博士前期課程)、Mohammad Jafar Sheikhi氏(博士研究員)、ケント州立大学(米国)のPratiksha Chaudhary氏、Grinsun Sharma氏、Hanbin Mao教授の国際共同研究グループで実施しました。本研究は、日本学術振興会(基盤B: 24K01623)AMED(JP25ak0101271 )、JST(JPMJSF2313、JPMJSP2116 )武田科学振興財団、小林財団の支援を受けて実施されました。
研究成果
研究グループは、
- G4に高い結合親和性をもつ化合物(6OTD)
- 細胞内のユビキチンリガーゼCRBNを引き寄せる分子(ポマリドミド)
を組み合わせ、世界初の G4結合タンパク質分解分子「G4L-PROTAC」 を設計・合成しました。実験により、以下を明らかにしました(図1):G4結合分子としては複数の既知リガンドが知られていますが、その中でも6OTDは高いG4選択性と細胞内活性が報告されており、標的G4への確実な結合を実現するために選定しました。一方、ユビキチンリガーゼをリクルートする分子としては複数のE3リガーゼリガンドが候補となりましたが、細胞内での発現レベルや汎用性を考慮し、ポマリドミド(CRBNリガンド)を採用しました。
さらに、両者をつなぐリンカー部分についても複数の長さ・構造を系統的に検討し、標的タンパク質の効率的な分解活性を示す組み合わせを探索しました。その結果、6OTDとポマリドミドを最適なリンカーで連結した構造が、G4結合タンパク質を細胞内で効率的に分解することを初めて実証し、G4L-PROTACの設計に至りました。G4L-PROTACを用いて以下の検討を行いました。
- G4L-PROTACはDNAやRNAに由来するG4構造に結合する。
- G4に結合した特定のタンパク質(例:DHX36、ヌクレオリン)を細胞内で選択的に分解する。
- 分解により細胞内にG4構造が顕著に蓄積することを確認(図2)。
これらの結果から、従来技術では不可能だった「まさに結合状態にあるG4結合タンパク質」の機能解析が可能となり、分子レベルでの遺伝子制御研究に新しい道を拓きました。
今後の展開
G4L-PROTACは、G4研究における強力な基盤ツールであると同時に、がんやウイルス感染症といったG4関連疾患を対象とした 新規創薬アプローチ に発展する可能性があります。今後は、より多様なG4構造やG4結合タンパク質に適用し、遺伝子発現制御機構の解明、さらには医療分野への応用を目指します。
用語解説
注1)グアニン四重鎖(G-quadruplex: G4)
DNAやRNAのグアニンが四重に積み重なって形成する特殊構造。遺伝子の転写や翻訳の調節因子として機能することが近年次々と報告されており、その発見は国際的に非常にホットな研究分野となっている。がんや老化、ウイルス感染など多くの疾患に関与することが明らかになり、創薬ターゲットとしても注目を集めている。
注2)G4結合タンパク質(G4BP)
G4構造に特異的に結合し、その安定性や機能を制御するタンパク質群。
注3)PROTAC
PROteolysis TArgeting Chimera の略。二つの機能を持つ分子で、標的タンパク質を細胞内の分解システムに誘導し、分解させる。
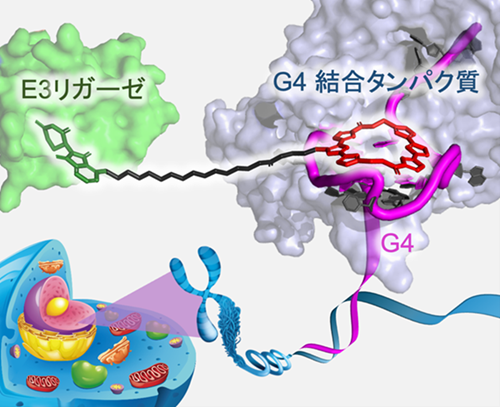
図1|G4L-PROTACによるG4結合タンパク質の分解の仕組み
G4L-PROTACは、G4構造に選択的に結合する分子(6OTD)と、細胞内のE3リガーゼであるCRBNを誘導する分子(ポマリドミド)をリンカーで連結した二官能性分子である。G4構造に結合したG4L-PROTACがE3リガーゼ(本文中では「ユビキチンリガーゼ」と同義)を近接させることで、G4結合タンパク質(例:DHX36、ヌクレオリン)がCRBNの基質として認識され、ユビキチン化されてプロテアソームで分解される。これにより、細胞内でG4に結合した状態のタンパク質を選択的に除去することが可能となる。(図はAngewandte Chemie Interanational Editionより改変)
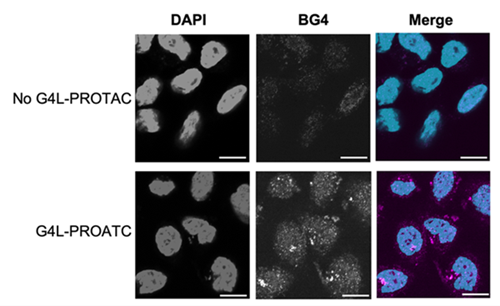
図2|G4L-PROTAC処理により細胞内のG4構造が顕著に蓄積する様子
ヒト細胞をG4L-PROTACで処理した後、核染色試薬DAPI(青)およびG4構造特異的抗体BG4(赤)で染色し、蛍光顕微鏡で観察した。DAPIは細胞核内のDNAに結合し、核の位置と形状を可視化する。一方、BG4はDNAやRNA中のG4構造を特異的に認識する抗体であり、G4構造の存在部位を赤色蛍光として示す。Merge画像では、核内に加え、細胞質中にも赤いシグナルが観察されるが、これはmRNAなどのRNA由来G4構造を示していると考えられる。G4L-PROTAC処理により、細胞内でG4構造の蓄積が顕著に増加していることが視覚的に示されている。(図はAngewandte Chemie Interanational Editionより改変)
◆研究に関する問い合わせ◆
東京農工大学大学院工学研究院生命機能科学部門
准教授 寺 正行(てら まさゆき)
TEL/FAX:042-388-7359
E-mail:tera(ここに@を入れてください)go.tuat.ac.jp
関連リンク(別ウィンドウで開きます)
